
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пояснения к работе. Электролитической диссоциацией называют процесс распада электролитов на ионы в водных растворах или в расплавах
|
|
Электролитической диссоциацией называют процесс распада электролитов на ионы в водных растворах или в расплавах. При диссоциации молекулы электролитов (кислот, солей, оснований) распадаются на положительно заряженные ионы, называемые катионами и отрицательно заряженные ионы, называемые анионами. Катионы и анионы в растворе химически связаны с молекулами воды – гидратированы, но для простоты написания уравнений электролитической диссоциации в них обычно гидратацию не показывают.
Кислоты.
Диссоциация кислот:
HCl 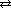 H+ + Cl-
H+ + Cl-
HNO3 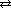 H+ + NO3-
H+ + NO3-
Диссоциация многоосновных кислот происходит ступенчато:
первая ступень H2S 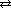 H+ + HS-
H+ + HS-
вторая ступень HS- 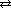 H+ + S2-
H+ + S2-
Из уравнений диссоциации видно, что общим для всех кислот является присутствие в растворе катионов водорода(H+).
Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода(H+).
Именно катионы водорода являются причиной общих свойств всех кислот: кислый вкус, изменение окраски индикаторов, взаимодействие с металлами, основными оксидами, основаниями.