
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение. Вода в водоеме соответствует санитарно-токсикологическим нормам в случае выполнения условия:
|
|
Вода в водоеме соответствует санитарно-токсикологическим нормам в случае выполнения условия:
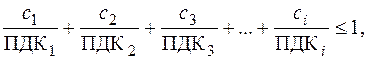
где сi – концентрация i -го загрязняющего вещества (иона), мг/л; ПДК i – предельно допустимая концентрация i -го вещества (иона) для воды хозяйственно-питьевого назначения, мг/л (табл. П. 2).
1. Запишем уравнение диссоциации нитрата аммония в воде
NH4NO3 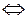 NH
NH 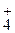 + NO
+ NO 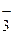 .
.
Следовательно, оценить соответствие водоема санитарно-токсикологическим нормам можно по концентрации двух ионов: NH 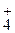 и NO
и NO 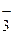 .
.
2. Определяем массу иона NH 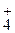 , попавшего в водоем:
, попавшего в водоем:
m (NH 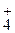 ) =
) = 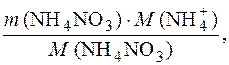
где m (NH 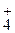 ) – масса иона NH
) – масса иона NH 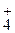 , г; m (NH4NO3) – масса нитрата аммония, г; М (NH
, г; m (NH4NO3) – масса нитрата аммония, г; М (NH 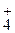 ) – молярная масса иона, г/моль; М (NH4NO3) – молярная масса нитрата аммония, г/моль.
) – молярная масса иона, г/моль; М (NH4NO3) – молярная масса нитрата аммония, г/моль.
Молярная масса NH4NO3 равна 80 г/моль; молярная масса иона NH 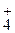 равна 18 г/моль.
равна 18 г/моль.
m (NH 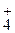 ) =
) = 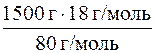 = 337, 5 г = 337500 мг.
= 337, 5 г = 337500 мг.
3. Определяем массу иона NO 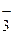 , попавшего в водоем:
, попавшего в водоем:
m (NО 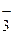 ) =
) = 
Молярная масса иона NО 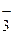 равна 62 г/моль.
равна 62 г/моль.
m (NО 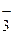 ) =
) = 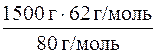 = 1162, 5 г = 1162500 мг.
= 1162, 5 г = 1162500 мг.
4. Рассчитаем объем воды в водоеме:
V = V водоема + V дожд. воды = 11, 5 м3 + 1, 0 м3 = 12, 5 м3 = 12500 л.
5. Определяем концентрацию ионов NH 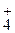 в мг/л:
в мг/л:
В 12500 л содержится 337500 мг ионов NH 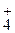
В 1 л –«– Х – «– – «–
Х = 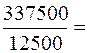 27 мг/л;
27 мг/л;
6. Определяем концентрацию ионов NО 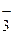 в мг/л:
в мг/л:
В 12500 л содержится 1162500 мг ионов NО 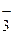
В 1 л –«– Х – «– – «–
Х = 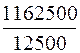 = 93 мг/л.
= 93 мг/л.
7. Определяем соответствие воды санитарно-токсикологическим нормам по ионам NH 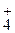 и NО
и NО 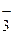 :
:
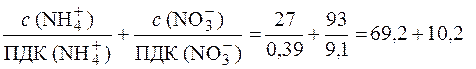 > > 1.
> > 1.
Таким образом, по нитрат-ионам и ионам аммония вода не соответствует санитарно-токсикологическим нормам.
Пример 3.3. Для очистки сточной воды от токсичного шести-валентного хрома Cr (VI) в виде K2Cr2O7 с концентрацией 1, 5 моль/л в качестве восстановителя использовали Na2SO3. Напишите уравнение реакции и рассчитайте количество реагента, необходимого для полного восстановления Cr (VI), находящегося в объеме 1, 5 м3 электролита.