
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергия Гиббса.
|
|
Самопроизвольное протекание изобарно - изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (Δ H), и энтропийным TΔ S, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (Δ G):
Δ G = Δ H – TΔ S
Размерность энергии Гиббса кДж/моль.
При постоянном давлении и температуре (р=const, T=const) реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса. Если ∆ G < 0, то реакциясамопроизвольно протекает в прямом направлении. Если ∆ G > 0, то самопроизвольное протекание процесса в прямом направлении в данных условиях невозможно, а возможно протекание обратного процесса. Если ∆ G = 0, то реакция может протекать как в прямом направлении, так и в обратном, и система находится в состоянии равновесия.
Изменение энергии Гиббса в ходе химической реакции (∆ 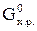 ) не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса продуктов реакции за вычетом суммы энергий Гиббса исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энергия Гиббса реакции
) не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса продуктов реакции за вычетом суммы энергий Гиббса исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энергия Гиббса реакции
aA + bB = сС + dD
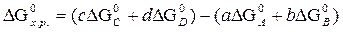 ,
,
где ∆ G0 – стандартная энергия Гиббса образования вещества, кДж/моль.
Энергия Гиббса образования простых веществ равна нулю. ∆ 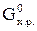 имеет ту же размерность, что и энтальпия, и поэтому обычно выражается в кДж.
имеет ту же размерность, что и энтальпия, и поэтому обычно выражается в кДж.
Изменение стандартной энергии Гиббса химической реакции может быть также вычислено по уравнению:
∆ 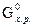 = ∆
= ∆ 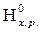 – Т ∆
– Т ∆ 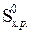 , где
, где
Т – абсолютная температура,
∆ 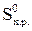 – изменениеэнтропии.
– изменениеэнтропии.
∆ Hх.р. – изменениеэнтальпии.
При химическом взаимодействии одновременно изменяется энтальпия, характеризующая теплосодержание системы, и энтропия, характеризующая стремление системы к беспорядку. Уменьшение энтальпии и рост энтропии - две движущих силы любого химического процесса.
Вклад энтальпийного и энтропийного факторов в величину изобарно-изотермического потенциала во многом определяется температурой:
1. При низких температурах преобладает энтальпийный фактор, и самопроизвольно протекают экзотермические процессы (DH< 0);
2. При высоких температурах преобладает энтропийный фактор, и самопроизвольно протекают процессы, сопровождающиеся увеличением энтропии (DS> 0).
На основании уравнения. Связывающего энергию Гиббса, энтальпию и энтропию можно дать следующую формулировку второго закона термодинамики: