
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Время реакции
|
|
Рис. 6.2. Зависимость скоростей прямой и обратной реакций
от времени их протекания.
В обратимой системе, находящейся в состоянии равновесия, концентрации всех участников процесса называются равновесными концентрациями, так как при этом постоянно и с одинаковой скоростью протекают как прямая, так и обратная реакции.
Количественную характеристику химического равновесия можно вывести, используя соответствующие кинетические уравнения:
V прям = V обр,
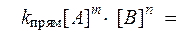
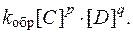
Так как константы скоростей реакций при фиксированной температуре постоянны, то будет постоянным и отношение
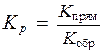 ,
,
называемое константой химического равновесия. Приравнивая правые части кинетических уравнений для прямой и обратной реакций можно получить:
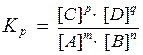 ,
,
где Kр - константа химического равновесия, выраженная через равновесные концентрации участников реакции.
Константа химического равновесия представляет собой отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов.
Например, для обратимой реакции
2NO2(г) 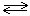 N2O4(г)
N2O4(г)
выражения для константы равновесия имеет вид:
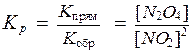 .
.
Если в процессе химического превращения участвуют две или несколько фаз, то в выражении для константы равновесия следует учитывать только те из них, в которых происходят изменения концентраций реагентов. Например, в выражение для константы равновесия для системы
CaCO3(т) 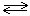 CaO(т) + CO2(г)
CaO(т) + CO2(г)
твердые вещества не включаются
Кр = [CO2].
Константа равновесия Kp - количественная мера способности реакции протекать «слева - направо» при заданном способе написания стехиометрического уравнения реакции. Константа равновесия показывает, во сколько раз прямая реакция идет быстрее обратной при одинаковой температуре и концентрациях, равных 1 моль/л.
Если Kp = 1, то реакция находится в состоянии химического равновесия и протекает в прямом и обратном направлениях с одинаковым выходом. Большим значениям константы равновесия (Kp > > 107) отвечают большие значения выхода (равновесных концентраций) продуктов прямой реакции; в равновесной смеси преобладают продукты прямой реакции. При очень больших значениях константы равновесия прямая реакция практически необратима. В обратном случае, если константа равновесия имеет малое значение (Kp < < 10-7), то практически необратимой является обратная реакция.