
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическое равновесие. Условия его смещения
|
|
46. Обратимыми являются реакции:
1) K2SO4 + BaCl2 = BaSO4 + 2KCl,
2) H2CO3 = H+ + [НСО3]–,
4) SO2 + H2O = H2SO3,
8) Zn + 2HCl = ZnCl2 + H2.
47. В обратимой реакции:
1) с самого начала реакции uпрям = uобр,
2) до установления равновесия uпрям убывает,
4) до установления равновесия uобр возрастает,
8) при данных условиях реакция одновременно протекает в прямом и обратном направлении.
48. Укажите ошибочное высказывание.
В равновесной системе
3H2 + N2 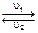 2NH3:
2NH3:
1) концентрации H2, N2 и NH3 не изменяются со временем,
2) u1 = u2,
3) число молекул NH3, распадающихся в единицу времени, равно половине общего числа молекул H2 и N2, образующихся за это время,
4) общее число молекул H2 и N2, превращающихся в единицу времени в NH3, равно числу молекул NH3, образующихся за это же время.
49. Укажите номер или сумму условных номеров, под которыми приведены правильные ответы. Химическое равновесие в системе: 2SO2 + O2 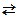 2SO3 ∆ Н ˂ 0 нарушит:
2SO3 ∆ Н ˂ 0 нарушит:
1) уменьшение давления в системе,
2) нагревание,
4) увеличение концентрации кислорода.
50. Укажите номер или сумму условных номеров, под которыми приведены правильные ответы. Чтобы сместить равновесие в системе N2 + 3H2 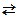 2NH3 ∆ Н ˂ 0 влево, надо:
2NH3 ∆ Н ˂ 0 влево, надо:
1) ввести в систему H2,
2) удалить из системы NH3,
4) повысить давление,
8) увеличить температуру.
51. Для смещения равновесия реакции 2SO2 + O2 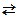 2SO3 ∆ Н ˂ 0 вправо, необходимо:
2SO3 ∆ Н ˂ 0 вправо, необходимо:
1) нагреть систему,
2) ввести в систему O2,
4) ввести в систему SO3,
8) уменьшить давление в системе.
52. Правилу (принципу) Ле Шателье не соответствует утверждение:
1) повышение температуры смещает равновесие в сторону эндотермической реакции;
2) понижение температуры смещает равновесие в сторону экзотермической реакции;
3) повышение давления смещает равновесие в сторону реакции, ведущей к увеличению объема;
4) уменьшение объема системы смещает равновесие в сторону реакции, ведущей к образованию меньшего числа газообразных молекул.
53. Укажите номер или сумму условных номеров, под которыми приведены правильные ответы. Повышение температуры сместит равновесие вправо в системах:
1) 2SO3 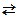 2SO2 + O2 ∆ Н ˃ 0,
2SO2 + O2 ∆ Н ˃ 0,
2) 2H2 + O2 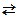 2H2Oпар ∆ Н ˂ 0,
2H2Oпар ∆ Н ˂ 0,
4) 2NO 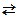 N2 + O2 ∆ Н ˂ 0,
N2 + O2 ∆ Н ˂ 0,
8) 2NH3 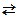 N2 + 3H2 ∆ Н ˃ 0.
N2 + 3H2 ∆ Н ˃ 0.
54. Укажите номер или сумму условных номеров, под которыми приведены правильные ответы. Понижение давления сместит равновесие вправо в системах:
1) 2SO3 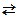 2SO2 + O2,
2SO2 + O2,
2) 2H2 + O2 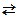 2H2O(пар),
2H2O(пар),
4) 2NO 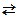 N2 + O2,
N2 + O2,
8) 2NH3 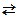 N2 + 3H2.
N2 + 3H2.
55. Одновременное понижение давления и повышение температуры сместит равновесие вправо в системе:
1) 2SO3 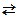 2SO2 + O2 ∆ Н ˃ 0,
2SO2 + O2 ∆ Н ˃ 0,
2) PCl3(г) + Cl2 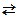 PCl5(г) ∆ Н ˂ 0,
PCl5(г) ∆ Н ˂ 0,
3) CO + H2O(пар) 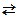 CO2 ∆ Н ˂ 0,
CO2 ∆ Н ˂ 0,
4) N2 + О2 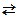 2NО ∆ Н ˃ 0.
2NО ∆ Н ˃ 0.
56. Как следует изменить температуру и давление в системе
3O2 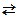 2O3 ∆ Н ˃ 0,
2O3 ∆ Н ˃ 0,
чтобы равновесие сместилось в сторону образования кислорода?
Температуру: Давление:
1) увеличить, увеличить,
2) уменьшить, уменьшить,
3) увеличить, уменьшить,
4) уменьшить, увеличить.
57. Укажите номер или сумму условных номеров, под которыми приведены правильные ответы. На положение (смещение) химического равновесия влияют:
1) давление реагирующих и образующихся газообразных веществ,
2) температура системы,
4) концентрация реагирующих и образующихся газообразных веществ,
8) катализатор.
58. На графике приведено изменение во времени концентрации веществ в системе:
H2(г) + I2(г) 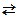 2HI(г).
2HI(г).
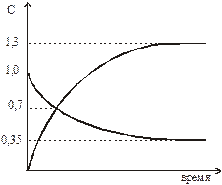
Определите, при каких значениях концентрации H2 и HI в системе устанавливается равновесие?
1) H2 – 0, 7; HI – 0, 7,
2) H2 – 0, 7; HI – 0, 5,
3) H2 – 0, 35; HI – 1, 3,
4) H2 – 0, 7; HI – 0, 35.
59. Укажите номер или сумму условных номеров, под которыми приведены правильные ответы. Принцип Ле Шателье:
1) определяет направление смещения равновесия,
2) применяется к химическим процессам,
4) применим к физическим процессам,
8) применим к процессам растворения газов в воде.
60. На графике приведено изменение во времени концентраций веществ в системе

 2NH3 кат. 3H2 + N2.
2NH3 кат. 3H2 + N2.
Пользуясь стехиометрическими коэффициентами, определите по графику вещества A, B и C. Укажите номер правильного ответа.
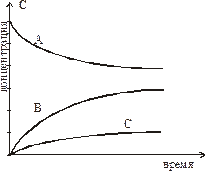
А B C
1) NH3 H2 N2
2) NH3 N2 H2
3) H2 N2 NH3
4) N2 H2 NH3
61. Укажите ошибочное высказывание. Изменение температуры равновесной системы:
1) смещает положение равновесия,
2) больше сказывается на скорости эндотермической реакции,
3) больше сказывается на скорости экзотермической реакции,
4) больше сказывается на скорости той реакции, которая имеет большую Еа.
62. Кинетическим уравнением для реакции
H2(г) + I2(г) ® 2HI(пар)
является выражение:
1) u = 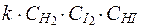 ,
,
2) u = 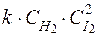 ,
,
3) u = 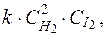
4) u = 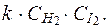
63. Укажите номер или сумму условных номеров, под которыми приведены правильные ответы. Константа скорости (k) гомогенной реакции A (г) + B (г) ®:
1) равна скорости реакции при CA = CB = 1,
2) зависит от присутствия катализатора,
4) зависит от температуры,
8) зависит от природы веществ А и В.
16) зависит от концентрации веществ А и В.
64. Во сколько раз увеличится скорость реакции:
H2(г) + I2(г) ® 2HI(г), если давление в системе увеличить в 4 раза?
1) 16, 2) 8, 3) 4, 4) 32.
65. Во сколько раз увеличится скорость реакции:
H2(г) + I2(г) ® 2HI(г), если концентрацию водорода увеличить в 10 раз?
1) 20, 2) 100, 3) 5, 4) 10.
66. Состоянию равновесия в системе H2 + I2(г)  2HI
2HI
не соответствует формула:
1) Kp = 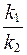 ,
,
2) k 1[H2] Ч [I2] = k 2[HI]2,
3) 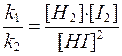 ,
,
4)  .
.
67. На константу равновесия (Kp) влияет:
1) давление,
2) температура,
3) концентрация,
4) катализатор.