
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пример. Схема электролиза раствора сульфата калия с инертным анодом
|
|
Схема электролиза раствора сульфата калия с инертным анодом. K2SO4 = 2K+ + SO42
H2O = H+ + OH-

 катод(-) 2K+, H+(H2O) SО42-, OH(H2O) (+)анод
катод(-) 2K+, H+(H2O) SО42-, OH(H2O) (+)анод
2H2O + 2e- = H2 + 2OH- 2H2O – 4e- = O2 + 4H+
K+ + OH- = KOH 2H+ + SO42- = H2SO4
Так как калий в ряду стандартных электродных потенциалов стоит значительно раньше водорода, то на катоде идет восстановление водорода и накопление ионов ОН-
У анода будет идти окисление молекул воды и накопление ионов Н+. Таким образом, в катодном пространстве вторичным продуктом будет щелочь, а в анодном – кислота.
Пример.
Электролиз водного раствора сульфата никеля с активным анодом. Ni SO4 = Ni2+ = SO42-

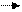 H2O H+ + OH-
H2O H+ + OH-

 катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод
катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод
Ni2+ +2e- = Ni0 Ni – 2e- = Ni2+
e0Ni = -0.25B больше потенциала восстановления ионов водорода из воды(-0, 41В), поэтому восстанавливается металл, а на аноде происходит окисление анода-металла, так как потенциал никеля намного меньше потенциала окисления воды (+1, 23В).