
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пример 3. Расчёты с активностями электронов
|
|
Дано: рассчитайте активность электронов и соотношение концентраций окисленной и восстановленной форм олова при Т = 298 К в системе:
(NO3)- + 2H+ +e ® NO2 + H2O Eo = +0, 790 В
Sn4+ +2e ® Sn2+ Eo = +0, 150 В
при рН =1, 0, концентрации (NO3)-, равной 1, 000 моль/дм3 и р (NO2) = 0, 0020× ро
Решение: в нестандартных условиях потенциал первой полуреакции определить по уравнению:

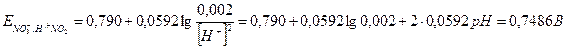
Активность электронов рe – = F× Еh /2, 3 RT или
в стандартных условиях (р = 101, 3 кПа, Т = 298 К) рe – = 16, 9 Еh = 16, 9× 0, 7486 = 12, 65
В состоянии равновесия электрохимические потенциалы всех существующих в этой системе окислительно - восстановительных пар равны между собой: 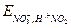 =
= 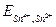 , и DЕ = 0
, и DЕ = 0


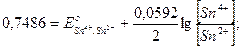

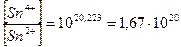
Ответ: соотношение окисленной и восстановленной форм олова 1, 67× 1020 свидетельствует опрактически полном окислении ионов Sn2+.
Пример 4. Можно ли использовать эту реакцию для определения концентрации растворенного в воде кислорода: I2 + 2Na2S2O3 = Na2S4O6 + 2NaI?
Решение: найдём справочные величины стандартных значений потенциалов полуреакций
(1) I2 + 2е ® 2I- Ео = +0, 536 В
(2) 2S2O32- + 2е = S4O62- Ео = +0, 080 В
_________________________________________________________________
I2 + 2S2O32- = S4O62- + 2I- Еообщ = +0, 456 В
стандартное значение потенциала полуреакции восстановления кислорода:
рН = 0 рН = 7 рН = 14
| 2Н+ + 1/2О2 + 2е = Н2О (рН£ 7) Н2О + 1/2О2 + 2е = 2ОН- (рН³ 7) | Е2 =1, 23 - 0, 0592pH | 1, 23 | 0, 82 | 0, 40 |
Ответ: из сопоставления величин стандартных электрохимических потенциалов видно, что данную реакцию можно использовать для определения растворённого кислорода в кислой (DЕ = 1, 23 – 0, 456 > 0) и нейтральной (DЕ = 0, 82 – 0, 456 > 0) средах и нельзя использовать в щелочной среде.
Некоторые справочные данные, необходимые для решения задач:
Растворимость кислорода в воде при 25 оС и давлении р = 101.315 кПа равна 0, 0283 об. в 1 объёме воды.
Уравнение газового состояния: 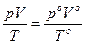 , где ро, Vo, То – параметры, измеренные при нормальных условиях (ро = 101, 315 кПа, То = 273 К).
, где ро, Vo, То – параметры, измеренные при нормальных условиях (ро = 101, 315 кПа, То = 273 К).
Уравнение Менделеева – Клапейрона: рV= nRT, n = m/M, где М – молярная масса.
Состав воздуха: 78, 084 % азота, 78, 084 % кислорода, 0, 934 % аргона, 3, 65∙ 10− 2 % углекислого газа.
БПК – биологическое потребление кислорода - это масса кислорода, расходуемого на биохимические процессы (прил. 5). Единицы измерения мг/л. Если условно принять суммарное соотношение жизненно необходимых элементов, входящих в состав органического соединения, простейшая формула которого CxHyOzN, тогда расход кислорода при дыхании отвечает схеме:
CxHyOzN + (x + y/4 – z/2 – 3/4)O2 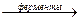 xCO2 +
xCO2 + 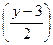 H2O + NH3 + Q, где коэффициенты перед молекулой кислорода означают: х –на один атом углерода расходуется одна молекула кислорода; y – на один атом водорода расходуется ¼ молекулы кислорода; содержащийся в соединении кислород вычитают – каждый атом составляет половину молекулы кислорода (z/2); азот восстанавливается до аммиака с затратой трёх атомов водорода, что соответствует уменьшению расхода кислорода ещё на 3/4 молекулы. БПКполн – расход кислорода (мг/л) на биохимические процессы до наступления реакции нитрификации:
H2O + NH3 + Q, где коэффициенты перед молекулой кислорода означают: х –на один атом углерода расходуется одна молекула кислорода; y – на один атом водорода расходуется ¼ молекулы кислорода; содержащийся в соединении кислород вычитают – каждый атом составляет половину молекулы кислорода (z/2); азот восстанавливается до аммиака с затратой трёх атомов водорода, что соответствует уменьшению расхода кислорода ещё на 3/4 молекулы. БПКполн – расход кислорода (мг/л) на биохимические процессы до наступления реакции нитрификации:
С xHyOzN + (x + y/4 – z/2 + 3/2)O2 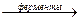 xCO2 +
xCO2 + 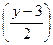 H2O + NО3- + y/4× 2Н+ + Q
H2O + NО3- + y/4× 2Н+ + Q