
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Воздействие металлической пыли
|
|
Мельчайшие частицы металлов или ионы металлов, попадая в кровь, вызывают образование токсичных продуктов биохимических реакций в клетках. К числу наиболее опасных ядовитых металлов — загрязнителей окружающей среды относится свинец. В качестве антидетонационной добавки к моторному топливу тетраэтилсвинец (ТЭС) постепенно утрачивает свое значение, а значит, главный источник загрязнения свинцом окружающей среды теперь все больше отходит на задний план. Свинец может попадать в природную среду и при металлургических процессах, когда перерабатываются руды, содержащие сульфиды; он содержится в красках, служащих антикоррозийными покрытиями (Pb3O4), может выделиться и из оцинкованной посуды (в цинке возможны примесь свинца), из глазури в керамической посуде (где также возможна примесь свинца), свинцового стекла, особенно при потpe6лeнии кислых блюд и напитков.
Загрязнение окружающей среды свинцом также может осуществляться при использовании свинецсодержащих соединений, например умягчителей и пластмасс, при пользовании свинцовыми аккумуляторами и в целом ряде областей техники и производственных процессов, где применяются продукты, содержащие свинец.
На тех производственных участках, где высвобождается свободный свинец, действует норматив, устанавливающий предельно допустимую концентрацию на уровне 0, 1 мкг свинца на 1 л воздуха. При этом в крови возникает концентрация свинца 0, 6 мкг/мл, что примерно соответствует его концентрации в моче 0, 06 мкг/мл. Признаки заболевания наблюдаются при содержании свинца в крови 1 мкг/мл или соответственно 0, 1 мкг/мл в моче. Признаки отравления выражаются в действии на ткани гладких мышц, в нарушениях гемосинтеза в костях и в воздействии на моторную (управляющую двигательной активностью) нервную систему; у детей отмечается заметное замедление умственного развития.
Металлический кадмий входит в состав различных сплавов, идет на изготовление никель-кадмиевых аккумуляторов встречается в иле сточных вод и в мусоре больших городов, вместе с фосфорными удобрениями (особенно производства африканских стран) попадает в почву, содержится но многих люминисцентных составах, высвобождается в следовых количествах при всех процессах горения. Как правило, в окружающую среду попадают только следы кадмия, но этот металл обладает способностью накапливаться в организме и через несколько лет его концентрация при систематическом поглощении тканями организма будет во много раз превышать исходную. Связываясь со специфическим белком переносчиком, так называемым металлотионином, существование которого было установлено по поглощению организмом тяжелых металлов, кадмий особенно накапливается в коре надпочечников. У малолетних детей биологический период полувыведения (время, в течение которого из организма выводится половина поглощенного вещества) кадмия, связанного с металлотионином, составляет около 35 лет, у людей в зрелом возрасте около 12 лет. Наряду с этим видом поглощения кадмий, подобно кальцию, откладывается в костях, образуя трехзамещенный фосфат кадмия. Одновременно ионы Са2+ вымываются из костей, что сопровождается 6олезненным усыханием скелета. Это заболевание впервые было открыто в Японии, получив название болезнь итаи-итаи. Наряду с воздействием на костную систему в результате систематического отравления кадмием на зубах появляется желтоватый налет CdS, происходит патологическое изменение слизистой оболочки носоглотки, сопровождающееся снижением числа эритроцитов и почечной недостаточностью. Опыты с крысами показали возможность возникновения рака легких под действием аэрозолей CdСl2, следовательно существует опасность канцерогенного воздействия биологически активных ионов кадмия на человека.
Вследствие высокой токсичности и необычайно большого периода полувыведения кадмия его ПДК составляет 0, 05 мг/м3 воздуха. Принимаемая с пищей доза не должна превышать 0, 5 мг в неделю. Благодаря повышенной способности кадмия связываться с металлотионином между сывороткой крови и мочой не устанавливается состояние равновесия, и определяемая концентрация кадмия в моче не может дать истинного представления о его содержании в организме человека.
Пылеобразные алюминий и бериллий, в отличие от свинца и кадмия, непосредственно поражают организм, осо6енно органы дыхания. Мельчайшая алюминиевая пыль и пыль, образующаяся при изготовлении корундовых точильных кругов (корунд — кристаллический Al2O3), при вдыхании вызывает воспаление бронхов и легких. При длительном воздействии они могут даже вызвать фиброз легких (изменение соединительных тканей). Бериллиевая пыль вызывает фиброгранулому (зарубцовывание соединительных тканей) в легких. При неоднократном поглощении бериллия и его соединений последние могут оставаться в легких, печени и клетках исключительно долго, в результате чего возникает гранулома печени и почек. Выделение бериллия из организма может затянуться на десятилетия. Поэтому при отравлении бериллием необходимо учитывать возможность возникновения в высшей степени долговременных повреждений организма.
Растворимые в воде соединения алюминия могут удерживаться в пищеварительном тракте. При их длительном нахождении возможно нарушение обмена кальция и фосфата, сопровождающееся размягчением костей.
Твердая металлическая пыль таких металлов, как вольфрам, молибден, титан, а также томас-шлак (отход металлургического производства) еще не выявленным путем снижает устойчивость легких к инфекции, что приводит к вспышкам инфекционных заболеваний в тех районах, где имели дело с подобными веществами.
6.1.4. Пыль и аллергические заболевания
Пыль разного вида и различного происхождения может вызвать у людей аллергию. Под аллергией понимают повышенную чувствительность организма к воздействию определенных веществ. При аллергии проявляются различные симптомы заболевания: воспалительные процессы (раздражение), усиленная секреция слизистых оболочек, отеки и др. Различают виды аллергического воздействия в зависимости от времени между контактом с аллергеном и проявлением болезненных симптомов: немедленное воздействие, когда это время длится от нескольких минут до нескольких часов, и замедленное воздействие, когда это время может занять несколько суток. Для того чтобы вызвать аллергию, аллерген должен прийти в соприкосновение с объектом или войти с ним во внутренний контакт. При этом в реакции антиген-антитело организм вырабатывает специфическое антитело против чужеродного вещества. При повторном контакте с подобным антигеном, или аллергеном, образуется специфический комплекс антиген-антитело, так называемые лаброциты в крови, назначение которых состоит в высвобождении медиаторов, например, гистамина.
В качестве аллергенов могут проявлять себя белки, либо другие вещества, которые могут связываться с белками. Таким образом, аллергическое действие могут оказывать разные продукты и материалы (табл. 6.1).
Некоторые виды пыли, вызывающие аллергию.
Таблица 6.1.
| Происхождение аллергена | Источник аллергена |
| Химикаты и металлы: Искусственные смолы, формалин | Промышленность |
| Платина, ванадий, бериллий, никель, кобальт, ртуть | Строительные материалы, металлургия, украшения |
| Хинин, пенициллин и т. п. | Аптеки, больницы |
| Средства борьбы с вредителями | Повсеместно |
| Волосы, перья, перхоть животных: насекомые, клещи | Повсеместно |
| Перламутр | Украшения, пуговицы |
| Домашние животные | Жилища |
| Шкуры животных (меха) | Зоофермы, одежда |
| Перья птиц | Домашние птицы, обивка мебели (подушки, перины) |
| Материалы растительного происхождения: Споры, пыльца | Повсеместно |
| Эфирные масла | Растения |
| Мох, конопля, джут, волокна | Мебельные обивочные материалы |
| Мука | Мукомольные и хлебопекарные производства |
| Кофе и какао (зерна и бобы) | Торговые суда |
| Древесная пыль | Столярные мастерские |
| Гуммиарабик (клей) | Типография |
| Ферменты | Моющие средства, лекарства |
6.2. Газы
6.2.1. Выбросы в атмосферу, перенос и проникновение в организм
При рассмотрении газов необходимо учитывать: Эмиссию (выброс), перенос (трансмиссию) и иммиссию (ввод) вредных веществ в организмы и ткани растений.
При вы6росе газов учитывают высоту расположения выходного отверстия над поверхностью земли, скорость выброса, общее количество газа, его температуру и скорость распространения. При этом для оценки загрязненности атмосферы особенно важно знать природу и массу выбросов. Все эти данные получают с помощью современной измерительной техники.
Значительно сложнее обстоит дело с выяснением условий переноса выбросов. Их техническая оценка может быть осуществлена лишь до известной степени.
В то время как перенос пыли в первую очередь зависит от размеров и плотности частиц, а также от перемещения воздушных потоков, распространение газов в основном определяется их растворимостью в воде и способностью к химическому взаимодействию с компонентами атмосферы. Их наличие в атмосфере зависит от того, ограничивается ли перенос 100-километровой зоной или распространение принимает глобальный характер. Среди газов, имеющих тенденцию к глобальному распространению, можно назвать CO2, в то время как SО2 и NО2, подобно пыли в тропосфере, сохраняются в атмосфере от нескольких дней до нескольких недель.
Перенос также связан с метеорологическими условиями и особенностями земной поверхности. Направление переноса выбросов определяется направлением ветра, а высота подъема выбросов — его скоростью. С увеличением скорости ветра перемешивание газов с окружающим воздухом становится все более интенсивным, что приводит к разбавлению выбросов. Большая скорость ветра препятствует подъему выбросов, ограничивая их распространение в вертикальном направлении. Аналогично на направление распространения выбросов влияет и температура отдельных слоев воздуха. Обычно в тропосфере температура падает на 1°С с увеличением высоты на 100 м, при этих условиях выбросы могут беспрепятственно подниматься вверх.
Особым случаем установления постоянного вертикального распределения выбросов служит инверсия, при которой с ростом высоты увеличивается и температура воздуха. Такое явление возникает при внезапном ночном охлаждении слоев воздуха, прилежащих к земной поверхности, или при наложении потока теплого воздуха на нижние холодные слои. Инверсия приводит к увеличению концентрации выбросов, в результате чего при достаточной солнечной радиации может наблюдаться образование смога. Обычно различают приповерхностную и высотную инверсии. В первом случае температура воздуха в нижних слоях имеет минимальное значение и постепенно увеличивается с высотой, это препятствует подъему выбросов, расположенных у земной поверхности. Приповерхностная инверсия с наступлением дня при сильном солнечном освещении быстро исчезает. Только осенью и зимой, когда земля едва прогревается, она может сохраняться в течение дня. При верхней инверсии слой воздуха с инверсионным температурным градиентом лежит над слоем воздуха с нормальным перепадом температур. При этом все выбросы, расположенные под нижним инверсионным слоем, загрязняют прилегающее к земле воздушное пространство.
Иногда восходящие потоки воздуха в центре области высокого давления также не могут поднять выбросы от земли в тех случаях, когда рельеф местности препятствует их горизонтальному распространению.
Сильное нагревание поверхности земли вызывает вертикальные потоки воздуха, этот восходящий воздух увлекает вверх все выбросы с земной поверхности.
При горизонтальном распространении выбросов решающим фактором служит преобладающее направление ветра. Перенос газов зависит также и от погодных условий: дожди и снег задерживают растворимые в воде компоненты, ограничивая их распространение. В то же время накопление в облаках растворимых в воде газов может нарушить естественный процесс распределения выбросов в атмосфере.
Под иммиссией понимают введение или наличие посторонних веществ в определенном объеме воздуха, оказывающее вредное воздействие. При этом подразумевается конкретное воздействие на живой организм, на определенный объем или площадь внутри строения, а также на определенный участок местности.
При установлении иммиссий не следует рассматривать только общее состояние атмосферы. Поскольку речь идет о действии на живые организмы, необходимо учитывать и те вредные вещества, которые содержатся в незначительных количествах, так как они могут находиться в изолированных помещениях или в помещениях с недостаточным обменом воздуха.
6.2.2. Монооксид углерода (СО)
Монооксид углерода образуется при неполном сгорании углеродсодержащих веществ. В атмосфере содержится ~60 млн тонн СО, если атмосфера не загрязнена.
Небольшие количества монооксида углерода природного происхождения образуются в результате вулканической деятельности и окисления метана в атмосфере. Эта реакционная цепь пока еще полностью не установлена, но, по-видимому, окисление осуществляется с помощью ОН·-радикалов. Исходным веществом для образования этих радикалов служит тропосферный озон, который под действием ультрафиолетового излучения с длиной волны менее 310 нм выделяет возбужденный, кислород O (1D). Этот возбужденный кислород в тропосфере с водяными парами образует радикалы ОН·. Радикалы ОН· окисляют метан в многостадийном процессе, где заключительной стадией является образование СО, который, видимо с помощью других радикалов ОН·, может превращаться в СО2.
К естественным источникам образования СО добавляются антропогенные выбросы. Это связано в первую очередь с автотранспортом, так как у двигателей внутреннего сгорания оптимальные условия окисления топлива создаются только при выходе на определенный рабочий режим. Еще меньше СО попадает в атмосферу за счет курильщиков (хотя и эти малые количества представляют опасность в местах большого скопления людей, где эффект разбавления проявляется в недостаточной степени).
Монооксид углерода представляет опасность для человека. Он может связываться с гемоглобином крови. Также он участвует в образовании смога. Кроме того, СО может образовывать высокотоксичные соединения – карбонилы.
При взаимодействии с гемоглобином (Hb) крови монооксид углерода, как и кислород, занимает координационное положение 6 в геме (Гем — это комплексное соединение железа, в котором ион железа(II) соединен с протопорфириновой группой. Гем входит в состав гемоглобина, его функция заключается в переносе кислорода).
Сродство гемоглобина к СО в 200—300 раз выше чем сродство к О2 (большой разброс значений данных объясняется, очевидно, существованием различных форм гемоглобина). Реакция гемоглобина (Hb) с O2, как и реакция с СО, подчиняется закону действующих масс, поэтому, учитывая, что его сродство к СО в 300 раз больше, чем к О2, можно написать:
[Hb] ·[СО] 300 · Р со

 = (6.6)
= (6.6)
[Hb] ·[О2] Р о2
Подставляя в уравнение одинаковые количества [Hb] · [О2] и [Hb] · [СО], получаем:
Р о2= 300 · Р со или Р со = Р о2 / 300 (6.7)
Поскольку объемная концентрация О2 в воздухе составляет около 20%, находим концентрацию СО:
Р со = 20 / 300 = 0, 066 % (6.8)
необходимую для того, чтобы связать столько же гемоглобина, сколько связывает и атмосферный кислород. Иначе говоря, концентрация 0, 066% (об) в атмосфере достаточна для того, чтобы связать половину гемоглобина. В этом случае уже могут наблюдаться серьезные нарушения здоровья (табл. 6.2).
Признаки отравления при различном содержании комплекса Hb · СО в крови (реакция гемоглобина Hb с СО)
Таблица 6.2
| Концентрация СО в воздухе | Содержание Hb · СО в крови | Клинические симптомы |
| 60 млн-1 = 0, 006% (об.) | 10% | Ослабление зрения, легкая головная боль. |
| 130 млн-1 = 0, 013% (об.) | 20% | Боли в голове и теле, утомляемость, временная потеря сознания. |
| 200 млн-1 = 0, 02% (об.) | 30% | Потеря сознания, паралич, нарушение дыхания и жизнедеятельности. |
| 660 млн-1 = 0, 066% (об.) | 50% | Полная потеря сознания, паралич, прекращение дыхания. |
| 750 млн-1 = 0, 075% (об.) | 60% | В течение часа наступает летальный исход. |
Скорость связывания с угарным газом СО зависит и от концентрации СО, интенсивности обмена веществ в организме человека, в том числе от частоты дыхания. В то время как насыщение гемоглобина монооксидом углерода при объеме поступающего в легкие воздуха 10 л/мин с содержанием 0, 1%(об) СО достигается через 6 ч, при тяжелой работе и интенсивности дыхания 30 л/мин оно достигается уже менее чем через 2 ч (рис. 6.2).
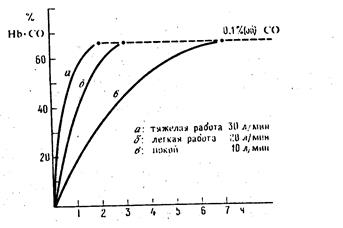
Рис.6.2 Насыщение гемоглобина при различной физической нагрузке
На горожанина-курильщика, особенно в закрытых помещениях, приходится двойная нагрузка: с одной стороны, действие СО, образующегося в результате выброса промышленными предприятиями и транспортом, с другой — СО, содержащегося в табачном дыме. В то время как у курильщиков — промышленных рабочих в крови обнаружено в среднем 5% Hb · СО, у некурящих рабочих содержание Hb · СО не превышало 1, 5%.
Непрерывное выделение СО наряду с его относительно длительным нахождением в атмосфере должно было бы привести к большему увеличению концентрации СО в воздухе, чем это наблюдается фактически. Такому накоплению СО препятствуют высшие растения, водоросли и особенно микроорганизмы почвы. Высшие растения в определенной степени могут связыват СО с помощью аминокислоты серина, возможно также окисление СО в СО2. В почве некоторые микроорганизмы также либо частично переводят СО в органические соединения, либо окисляют его в СО2. Поэтому почва играет особую роль в удалении СО из атмосферы.
6.2.3. Диоксид углерода (СО2)
Диоксид углерода образуется при полном окислении углеродсодержащего топлива. Атмосферный СО2, находящийся в состоянии постоянного обмена с почвой, водой и живыми организмами, т. е. создается круговорот его в природе.
В этом кругообороте источниками СО2 служат вулканические извержения, выветривание содержащих углерод горных пород, микробиологический распад органических соединений над почвой и в почве, дыхание животных и растений, лесные пожары и сжигание природного топлива. Выбросу СО2 противостоят процессы его фиксации из атмосферы: фотосинтез растений, растворение в морской воде, накопление соединений, богатых углеродом и отложение богатых углеродом залежей горючих ископаемых.
Между процессами высвобождения углерода при дыхании и связывания углерода при фотосинтезе установилось известное равновесное состояние, что характерно как для материков, так и для океанов. В такой обменный механизм включена только часть общего количества углерода всей биомассы.
Увеличение количества сжигаемого природного топлива с развитием индустриализации, особенно в течение последних 100 — 200 лет, привело к заметному повышению содержания СО2 в атмосфере.
Наряду с сжиганием природного топлива человек находит другой повод для вмешательства в природные «кладовые» углерода. В результате интенсивной обработки земли и создания новых пашен идет быстрое разрушение слоя гумуса в почве и ускоренный переход углерода в атмосферу. К этому добавляется вырубка лесов, особенно ликвидация тропической растительности, в которой издавна накопились огромные запасы углерода.
Попавший в атмосферу СО2 остается в ней в среднем 2 — 4 года. За это время СО2 повсеместно распространяется по всей земной поверхности, входя в состав атмосферы. Влияние СО2 выражается не только в токсичном действии на живые организмы, но и в способности поглощать инфракрасные лучи.
При нагревании земной поверхности солнечными лучами часть тепла в виде инфракрасного излучения отдается обратно в мировое пространство. Это возвращаемое тепло частично перехватывается газами, поглощающими инфракрасное излучение которые в результате нагреваются. Если это явление происходит в тропосфере, то с ростом температуры могут происходить климатические изменения («парниковый эффект»).
6.2.4. Диоксид серы (SO2)
В отличие от CO2, оказывающего влияние только на распределение энергии в атмосфере (благодаря поглощению ИК-лучей), диоксид серы может оказать и прямое токсическое действие на живые организмы. Кроме того, реакционная способность SO2 значительно выше, чем у СО2.
К природным источникам SO2 в первую очередь относятся вулканы, лесные пожары, морская пена и микробиологические превращения серусодержащих соединений. Выделяющийся в атмосферу SO2 может связываться известью, в результате чего в воздухе поддерживается его постоянная концентрация около 1 млн-1.
Диоксид серы антропогенного происхождения образуется при сгорании угля и нефти, в металлургических производствах, при переработке содержащих серу руд, при различных химических технологических процессах. Большая часть антропогенных выбросов SO2 (около 87%) связано с энергетикой и промышленностью.
Время пребывания SO2 в атмосфере в среднем исчисляется двумя неделями. Этот промежуток времени слишком мал, чтобы газ мог распространиться в глобальном масштабе. Поэтому в соседних географических районах, где осуществляются как большие, так и умеренные выбросы диоксида серы, в атмосфере может наблюдаться большое различие концентраций SO2. Таким образом, проблема SO2 возникает в первую очередь в высокоразвитых промышленных странах и у их ближайших соседей
Во время переноса диоксид серы SO2 и другие кислотные выбросы лишь в очень малой степени теряют свою активность. Нейтрализация происходит только том случае, если в воздухе, одновременно с SO2 находится пыль, содержащая гидроксиды щелочных и щелочноземельных элементов. Атмосфера очищается главным образом при вымывании кислых газов водой или снегом, а также при их «сухом» осаждении, т. е. в виде самого газа или адсорбированного на мельчайших частицах пыли. Кроме того, SO2 растворяется в мельчайших капельках тумана, которые после осаждения также относят к сухой части загрязнений. Остальная часть вымывается из атмосферы вместе с дождями и снегом.
Сухая часть загрязнений обычно выпадает либо в непосредственной близости от источника выброса, либо на незначительном удалении от него. При длительном переносе воздухом в основном выпадает связанная водой часть выбросов.
Влажную («мокрую») часть выбросов часто называют кислотными дождями. Этот термин следует применять, с известной осторожностью: он относится только к дождям неприродного происхождения и отвечает определенным критериям (кислотный дождь имеет рН 5, 6 и содержит повышенное количество сульфитов, сульфатов, нитритов, нитратов, хлоридов и фторидов или, по крайней мере, один из этих компонентов). Зная содержание вышеперечисленных анионов в осадочных породах, можно определить и рН осадков, выпадавших на землю во времена, когда еще не было промышленного развития.
У людей SO2 раздражает слизистую оболочку, вызывая сильный кашель. У взрослых и здоровых людей эти симптомы появляются только при концентрациях, соответствующих МЭК 5 млн-1 (13 мг/м3). В течение короткого времени воздействия можно выдержать и десятикратную концентрацию. Значительно сложнее обстоит дело с людьми, обладающими повышенной чувствительностью к SO2. К этой группе относится около 10% людей. У них уже кратковременное воздействие SO2 при концентрации 1, 3 мг/м3 вызывает спазмы дыхательных путей, и требуется немедленное медицинское вмешательство. Таким же образом реагируют на загрязнение атмосферы SO2 и больные астмой. Считают, что физиологическое действие SO2 в первую очередь связано с образованием H2SO3 на влажной слизистой бронхов. Аналогично действуют и аэрозоли серной кислоты. В тяжелых случаях может возникнуть отек легких. При длительном воздействия SO2 пропадает чувствительность к запахам и вкусам. В организме H2SO3 окисляется в H2SO4 и выводится почками, при этом понижается рН мочи, который в нормальных пределах лежит между 4, 8 и 7, 5.
Особая трудность при определении вреда, нанесенного организму действием SO2, заключается в том, что она часто проявляется совместно с действием других факторов, опасных для здоровья. Неоднократно наблюдалось, что при повышенной концентрации пыли токсичное действие SO2 проявляется значительно сильнее, чем в воздухе, свободном от пыли. После нескольких трагедий в Лондоне, связанных с образованием смога, было установлено, что при комбинированном воздействии пыли и SO2 смертность превысила обычное среднее значение. При coвместном действии SO2 и пыли возрастает опасность заболевания хроническим бронхитом. Синергизм совместного действия пыли и диоксида серы объясняют адсорбцией молекул SO2 на мельчайших частицах пыли, которые могут проникать в чувствительные альвеолы легких, не подвергаясь нейтрализации на слизистой оболочке бронхов.
Диоксид серы часто действует совместно с NOх; эта комбинация может значительно увеличить число заболеваний дыхательных путей. В связи с этим следует упомянуть, что распространенность псевдокрупа — воспаления гортани — в наше время связано с загрязнением окружающей среды.
Кислотные выбросы действуют не только на людей, они действуют и на животных, однако систематические наблюдения в этих случаях отсутствуют. Только обитателям вод было уделено большее внимание, так как последние особенно чутко реагируют на изменение рН среды обитания.