
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тұздар гидролизi
|
|
 Жұ мыстың мақ саты
Жұ мыстың мақ саты
Тұ здардың гидролиздену реакцияларын зерттеу,
ортаның рН-ө згерiсін жә не гидролиздiң
температура мен сұ йылтуғ а тә уелді екенін байқ ау.
Жұ мыстың мазмұ ны
а) Гидролиз кезiнде қ ышқ ылдық тұ здардың тү зiлуi.
б) Гидролиз кезiнде негiздік тұ здардың тү зiлуi.
в) Бiрнеше тұ здардың бірге гидролизденуi.
г) Температура мен сұ йылтудың гидролизге ә серi.
Жұ мыстың теориялық негізі
Гидролиз деп тұ з иондары мен су иондарының арасындағ ы реакцияны айтады. Реакция нә тижесiнде ә лсiз электролиттер тү зiледі жә не ерітiндi ортасының рН ө згереді.
I-жағ дай.
Кү штi негiзден жә не ә лсiз қ ышқ ылдан тү зiлген тұ здың гидролизi ә лсiз қ ышқ ылдың анионы арқ ылы жү редi:
СО32- + НОН 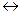 НСО-3 + ОН-
НСО-3 + ОН-
Na2CO3 + HOH 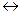 NaHCO3 + NaOH яғ ни pH > 7.
NaHCO3 + NaOH яғ ни pH > 7.
II-жағ дай.
Ә лсiз негiзден жә не кү штi қ ышқ ылдан тү зiлген тұ здың гидролизi ә лсіз негіздің катионы арқ ылы жү редi:
АI3+ + НОН 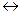 АIОН2+ + Н+
АIОН2+ + Н+
АIСI3 + НОН 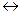 АIОНСI2 + НСI яғ ни pH < 7.
АIОНСI2 + НСI яғ ни pH < 7.
III-жағ дай.
Ә лсiз қ ышқ ылдан жә не ә лсiз негiзден тү зiлген тұ здың гидролизi катион жә не анион арқ ылы жү реді.
NН+4 + СН3СОО- + НОН 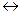 NН4ОН + СН3СООН
NН4ОН + СН3СООН
NН4СН3СОО + НОН 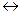 NН4ОН + СН3СООН яғ ни pH
NН4ОН + СН3СООН яғ ни pH 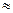 7.
7.
IV-жағ дай.
Ә лсiз негiзден жә не ә лсiз қ ышқ ылдан тү зiлген тұ здың гидролизi бiр саты бойынша жү ретін қ айтымсыз процес, егер реакция нә тижесiнде тү зiлген заттың бiрi газ кү йiнде болса:
АI2S3 + 6HOH 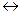 2AI(OH)3
2AI(OH)3 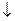 + 3H2S
+ 3H2S 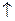 яғ ни pH
яғ ни pH 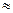 7.
7.
V-жағ дай.
Бiрнеше тұ здардың бірге гидролизі нә тижесiнде суда ерімейтiн немесе суда кездеспейтiн қ осылыстар тү зiледi.
АI2(SО4)3 + 3Nа2СО3 + 6HOH = 2АI(ОН)3 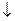 + 3Н2СО3 + 3Nа2SО4
+ 3Н2СО3 + 3Nа2SО4
2АI3+ + 3СО32- + 6НОН = 2АI(ОН)3 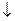 + 3Н2СО3 яғ ни pH
+ 3Н2СО3 яғ ни pH 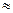 7.
7.