
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химиялық реакцияның жылдамдығы
|
|
Жұ мыстың мақ саты
 Химиялық реакцияның жылдамдығ ының заттардың концентрациясына жә не температурағ а тә уелді екенін зерттеу.
Химиялық реакцияның жылдамдығ ының заттардың концентрациясына жә не температурағ а тә уелді екенін зерттеу.
Жұ мыстың мазмұ ны
а) Тиокү кірт қ ышқ ылының ыдырау жылдамдығ ының тиосульфаттың концентрациясына байланысты ө згеруі;
в) Тиокү кірт қ ышқ ылының ыдырау жылдамдығ ының температурағ а байланысты ө згеруі.
Жұ мыстың теориялық негіздері
Химиялық реакцияның жылдамдығ ы дегеніміз – уақ ыт бірлігіндегі заттың концентрациясының ө згерісі.
υ = (c2 – c1)/ (t2 - t2) =Dc/Dt
Химиялық реакцияның жылдамдығ ына кө птеген факторлар ә сер етеді: реагенттердің концентрациясы, температура, катализатор, сыртқ ы басқ а да ә серлер, ә рекеттесуші заттардың табиғ аты.
Химиялық реакциялардың концентрацияғ а тә уелділігі ә рекеттесуші массалар заң ы арқ ылы ө рнектеледі. Заң: “Химиялық реакциялардың жылдамдығ ы ә рекеттесуші заттардың стехиометриялық коэффициенттерінің дә режесіндегі концентрацияларының кө бейтіндісіне тең ”.
aА + bВ = сС
реакциясы ү шін, ә рекеттесуші массалар заң ының формуласы мынадай:
υ =k caAcbB
Химиялық реакциялардың температурағ а тә уелділігі Вант-Гофф ережесімен сипатталады: “Температураны ә рбір 100С ұ лғ айтқ анда, химиялық реакцияның жылдамдығ ы 2-4 есе артады”.
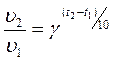
Бұ л жұ мыста химиялық реакцияның жылдамдығ ы тиокү кірт қ ышқ ылының ыдырау реакциясы арқ ылы зерттелінеді. Тиосульфат натрийғ а кү кірт қ ышқ ылын қ осқ анда тө мендегідей реакция жү реді:
Бұ л жұ мыста химиялық реакцияның жылдамдығ ы тиокү кірт қ ышқ ылының ыдырау реакциясы арқ ылы зерттелінеді. Натрий тиосульфатына кү кірт қ ышқ ылын қ осқ анда тө мендегідей реакция жү реді: