
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Свободная энергия и константа равновесия
|
|
Для любого химического процесса общее соотношение между изменением свободной энергии при стандартных условиях DGо и изменением свободной энергии при любых других условиях определяется выражением
DGо T = -RT× lnK, (5.4)
Если стандартное состояние определено при 298 К, то уравнение (5.4) может быть записано в следующем виде:
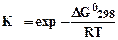 . (5.5)
. (5.5)
Рассчитав величину DGо298 химической реакции, можно определить константу равновесия. Из уравнения (5.4.) следует, что если величина DGо отрицательна, это означает, что К > 1. И наоборот, если DGо > 0, то К < 1.
Пример 4. Прямая или обратная реакция будет протекать при стандартных условиях в системе:
CH4(г) + СО2 (г) ⇆ 2СО (г) + 2Н2 (г).
DG0ƒ (кДж/моль) -50, 8 -394, 3 -137, 1 0
Запишите закон действия масс для этой реакции.
Решение: Для ответа на вопрос следует вычислить DGо298 или  прямой реакции. Последнее выражение и есть ЗДМ. Значения DG0298 соответствующих веществ приведены в таблице 4.1. Используя уравнение (4.6), рассчитываем DG0х.р.:
прямой реакции. Последнее выражение и есть ЗДМ. Значения DG0298 соответствующих веществ приведены в таблице 4.1. Используя уравнение (4.6), рассчитываем DG0х.р.:
DGох..р. = 2DGо, (СО) - DGо (СН4) - DGо (СО2) = 2·(-137, 1) - (-50, 8 - 394, 3) = +170, 9 кДж.
В соответствии с уравнением (5.5): 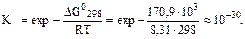
То, что DG > 0, а Kр < < 1, указывает на невозможность самопроизвольного протекания прямой реакции при T = 298К и равенстве давлений взятых газов 1, 013× 105 Па. Самопроизвольно при этих условиях будет протекать обратная реакция.
Пример 5. На основании стандартных энтальпий образования и абсолютных стандартных энтропий веществ (табл. 4.1) вычислите DG0298 реакции, протекающей по уравнению. Запишите закон действующих масс и вычислите Kp.
CO(г) + Н2О(ж) ⇆ СО2 (г) + Н2 (г),
DНоƒ, (кДж/моль) -110, 5 -285, 8 -393, 5 0
S0 (Дж/моль·К) 197, 5 70, 1 213, 6 130, 6
Решение: DGо = DНо - T DSо, DН и DS находим по уравнениям (4.3) и (4.4):
DНо x.p = (-393, 5 + 0) - (-110, 5 - 285, 8) = + 2, 80 кДж.
DSо x.p = (213, 6 + 130, 6) - (197, 5 + 70, 1) = 0, 0766 кДж/моль.
DGо x.p = +2, 80 - 298·0, 0766 = -20, 0 кДж.
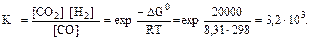
Концентрация Н2О (ж) принимается равной 1моль/л и не включена в ЗДМ, т.к. это конденсированное состояние.
Пример 6. Реакция восстановления Fe2O3 водородом протекает по уравнению
Fe2O3 (к) + 3H2 = 2Fe (к) + 3Н2О(г); DHох.р. = +96, 61кДж.
Запишите закон действующих масс для этой реакции. Возможна ли эта реакция при стандартных условиях, если изменение энтропии DS0 = 0, 1387 кДж/моль·К? При какой температуре начнется восстановление Fe2O3? Каково значение К при этой температуре?
Решение. Вычисляем DG0 реакции:
DGоx.p = DHо - TDSо·10-3 (кДж)= 96, 61 - 298·0, 1387 = 55, 28 кДж.
ЗДМ для этой реакции c учетом агрегатного состояния веществ: 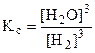 .
.
В то же время
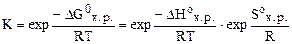 =
=
= 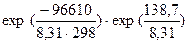 =
= 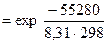 = 2·
= 2· 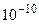 .
.
Так как DG > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой DG = 0. При этом DH0 = TDS0, отсюда
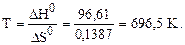
Следовательно, при температуре примерно 696, 5 К начнется реакция восстановления Fe2O3