
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
От концентрации реагентов
|
|
Так как скорость химической реакции зависит от столкновений, а количество столкновений в единице объема, очевидно, пропорционально концентрации сталкивающихся молекул, то можно пред
положить, что скорость реакции пропорциональна концентрациям реагентов, то есть для необратимой простой реакции
аА + bВ +.... = сС + dD +...
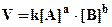 (6.3)
(6.3)
(закон действующих масс для кинетики).
Здесь k - константа скорости, то есть скорость реакции при [A] = [B] =
1 моль/л.
Эти рассуждения верны лишь в том случае, если реакция элементарная (в одном столкновении участвуют а молекул А, b молекул В) и при этом сразу образуются конечные продукты С, D и т. д. Если реакция сложная, то скорость зависит не только от [A] и [В], но и от концентраций промежуточных продуктов и скоростей их расходования, так что обычно коэффициенты в уравнении реакции не совпадают с а и b (они меньше их). В этом случае кинетическое уравнение записывается:
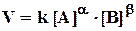 . (6.4)
. (6.4)
Коэффициенты а и b в уравнении (5.3) носят название “молекулярность” реакции по веществу А и В, соответственно; сумма (а + b) - суммарная (общая) молекулярность простой реакции. Понятие “молекулярность” применимо только к простой реакции. Вычисления и наблюдения показывают, что (а + b) не может быть больше трех. Если для какой-либо реакции эта сумма больше трех, то можно утверждать, что реакция сложная. По количеству сталкивающихся в элементарном акте молекул реакции называют моно-, би- и тримолекулярными.
Показатели aи b в уравнении (5.4) носят название “частный порядок” реакции по веществу А и В, соответственно, а сумма (a + b) - общий порядок реакции. Эти коэффициенты находят экспериментально, и они могут быть целыми, дробными, отрицательными и равными нулю.
Константа скорости (k) не зависит от концентраций реагентов, но зависит от природы реагентов, направления реакции (природы продуктов) и от температуры. Константу скорости находят из экспериментальных данных расчетом (известны V, [A], [B]...., a, b,...)
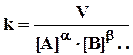 . (6.5)
. (6.5)
Как видно из этого выражения, размерность k зависит от порядка реакции:
для реакции первого порядка (a + b +...= 1) - с-1;
для реакции второго порядка - л·с-1·моль-1;
для реакции третьего порядка - л2·с-1·моль-2.
Особенности кинетики гетерогенных реакций. Гетерогенные реакции идут на поверхности раздела фаз, поэтому особенностью кинетики этих реакций является влияние площади реакционной поверхности (S) на скорость реакции, при этом константа скорости k = k¢ ·S.
Если в реакции участвуют твердые или жидкие вещества (не растворы), то их концентрация в уравнении (6.4), как и в ЗДМ для равновесия, не учитывается. Например, для реакции
CaOк + CO2 (г) = CaCO3 к
кинетическое уравнение имеет вид V = k[CO2]a = k¢ S[CO2]a,
а для реакции CaOк + H2Oж = Ca(OH)2 к - V = k = k¢ S.
Пример 1. Сложная необратимая реакция 2N2O5 = 4NO2 + O2 является реакцией первого порядка. Как изменится ее скорость при увеличении давления в 5 раз?
Решение. Кинетическое уравнение этой реакции в общем виде: V = k·[N2O5]a. Так как реакция сложная, то возможно, что a ¹ 2. По условию порядок реакции a = 1. Для газовых реакций роль концентрации выполняет давление. Поэтому V = kP, и если Р1 = 5Р, то V1/V = 5, т.е. скорость возрастает в пять раз.
Пример 2. Для реакции 2NO + H2 = N2O + H2O при 660 К измерена скорость при различных концентрациях NO и H2:
| NO, моль/л-1 | 0, 01 | 0, 01 | 0, 03 |
| H2 моль/л-1 | 0, 01 | 0, 02 | 0, 02 |
| V моль л-1 с-1 | 2, 5.10-3 | 5.10-3 | 45.10-3 |
Найти константу скорости, порядки по реагентам и записать кинетическое уравнение.
Решение. Кинетическое уравнение для скорости этой реакции в общем виде:
V = k[NO]a[H2]b.
Данные таблицы позволяют найти порядки реакции по NO (a) и H2 (b) методом понижения порядка реакции, т.е. анализируя опыты, в которых один из реагентов имеет неизменную концентрацию. Так, [NO] = 0, 01 в первом и втором столбцах, при этом [H2] изменяется в 2 раза и скорость при этом тоже возрастает в 2 раза, т.е. порядок по H2 (a) = 1.
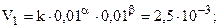

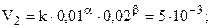
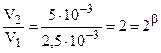 .
. 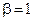 (частный порядок по H2).
(частный порядок по H2).
Для второго и третьего столбцов, наоборот, [H2] одинакова, а [NO] - различны, поэтому:

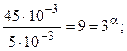
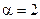
 (частный порядок по NO).
(частный порядок по NO).
Так как a и b совпадают со стехиометрическими коэффициентами, то реакция может быть простой. Константа скорости может быть найдена по данным каждого столбца:
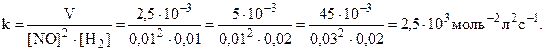
Таким образом, кинетическое уравнение: V = 2, 5.103[NO]2[H2].
Суммарный (общий) порядок этой реакции (a + b) равен 3.
Пример 3. Скорость реакции А + 3В = АВ3 определяется кинетическим уравнением V = k[А]·[B]. Определите общий порядок реакции. Какая это реакция – простая или сложная? Во сколько раз увеличится скорость реакции при увеличении концентраций в 3 раза?
Решение. Порядок реакции определяется суммой показателей степеней реагентов в кинетическом уравнении. Для данной реакции общий порядок равен двум (1 +1).
Если бы данная реакция была простой, то по закону действующих масс
V = k[А]1.[B]3 и общий порядок был бы равен (1+ 3) = 4, т.е. показатели степеней в кинетическом уравнении не совпадают со стехиометрическими коэффициентами, следовательно, реакция сложная и проходит в несколько стадий.
При увеличении концентраций реагентов в 3 раза: V1 = k·3[A]·3[B] = 32V, то есть скорость увеличится в 32 = 9 раз.