
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Свойства разбавленных растворов неэлектролитов. Неэлектролиты- вещества, растворы которых не проводят электрический ток
|
|
Неэлектролиты - вещества, растворы которых не проводят электрический ток. Разбавленные растворы неэлектролитов обладают рядом свойств (коллигативные свойства), которые зависят только от концентрации растворенного вещества и природы растворителя и практически не зависят от природы растворенных веществ.
1. Понижение давления пара растворителя над раствором. Первый закон Рауля. Давление насыщенного пара является весьма важным свойством растворов, с которым связан и ряд других свойств. В результате естественного испарения над жидкостью образуется пар. Одновременно с ним протекает экзотермический процесс конденсации. При определенных условиях устанавливается равновесие (DG = 0), которое при данной температуре характеризуется давлением насыщенного пара. При растворении нелетучего компонента в данном растворителе его концентрация уменьшается, и в результате уменьшается число молекул растворителя, переходящих в пар. Это вызывает нарушение равновесия жидкость-пар в сторону процесса конденсации, и давление пара над раствором снижается.
Следовательно, давление насыщенного пара растворителя над раствором (Р 1 ) всегда меньше, чем над чистым растворителем ( Р º 1 )
Понижение давления пара будет тем больше, чем больше концентрация (мольная доля χ в-ва) растворенного вещества в растворе:
DР = Р10·χ в-ва или 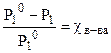 , (8.1)
, (8.1)
где 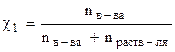 - мольная доля вещества (см. тему 6); ∆ Р - относительное понижение давления насыщенного пара растворителя.
- мольная доля вещества (см. тему 6); ∆ Р - относительное понижение давления насыщенного пара растворителя.
Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Пример 1. Имеется 30 %-й раствор глюкозы (С6Н12О6). На сколько понизится давление насыщенного пара над раствором, если давление пара воды при 25 0С составляет
3, 17 кПа? Вычислить давление насыщенного пара этого раствора.
Решение. Согласно выражению (7.6) найдем мольную долю вещества.
Молярная масса глюкозы равна 180 г/моль. В 30%-ном растворе содержится 30 г вещества и 70 г растворителя на каждые 100 г раствора.
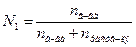 ;
; 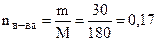 моль (С6Н12О6);
моль (С6Н12О6);
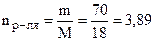 моль (Н2О).
моль (Н2О). 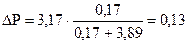 кПа.
кПа.
Р1 = Р01 - ∆ Р = 3, 17 - 0, 13 = 3, 04 кПа (3040 Па).
2. Температура кипения (Ткип). Ткип прямо связана с давлением насыщенного пара над жидкостью. Любая жидкость начинает кипеть при температуре, при которой давление ее насыщенного пара достигает величины внешнего давления.
Поскольку давление пара растворов, в соответствии с законом Рауля, снижается, то температура кипения растворов всегда выше, чем температура кипения растворителя на величину DТкип.
1-е следствие из закона Рауля: повышение температуры кипения раствора (DТкип) пропорционально моляльности раствора (Сm):
DТкип = Кэ·Сm, (8.2),
где DТкип = (Т1 - Т0); Т1 - температура кипения раствора; Т0 - температура кипения растворителя; Кэ - эбулиоскопическая постоянная растворителя.
3. Температура замерзания (кристаллизции) (Тзам). Понижение давления насыщенного пара растворителя над раствором понижает температуру замерзания раствора (Тзам.).
2-е следствие из закона Рауля: понижение температуры замерзания раствора (DТзам) пропорционально моляльности раствора (Сm):
DТзам = Кк·Сm, (8.3)
где DТзам = (Тº - Т1); Сm – моляльная концентрация, Кк - криоскопическая постоянная растворителя. Кэ и Кк зависят от природы растворителя и не зависят от природы реагирующих веществ.
Пример 2. При какой температуре будет кипеть и замерзать 30%-й раствор глюкозы (С6Н12О6)? КЭ и КК (Н2О) равны 0, 52 и 1, 86, соответственно.
Решение. Согласно (8.2) и (8.3) и (7.5):
DТкип = КЭ·Сm = 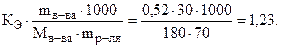 ; tкип = 100 + 1, 23 = 101, 23 º C,
; tкип = 100 + 1, 23 = 101, 23 º C,
DТзам = Кк·Сm 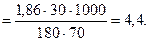 ; tзам = 0 - 4, 4 = -4, 4 º C.
; tзам = 0 - 4, 4 = -4, 4 º C.
4. Осмотическое давление. Осмос - явление односторонней диффузии через полупроницаемую перегородку, разделяющую раствор и чистый растворитель или два раствора разной концентрации.