
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Давление, которое требуется создать, чтобы остановить осмос из чистого растворителя в раствор, называется осмотическим (принцип Вант-Гоффа).
|
|
Pосм = CМ·R·T, (8.4)
где СМ - молярная концентрация раствора (число моль вещества на 1 л раствора); R - универсальная газовая постоянная; T - абсолютная температура.
Пример 3. Чему равно при температуре 7, 5 º C осмотическое давление раствора, в
1, 5 л которого содержится 276 г глицерина С3Н8О3?
Решение. Согласно закону Вант-Гоффа (8.4), Pосм =СМ·R·T.
Молярная масса глицерина равна 92 г/моль, что составит СМ = 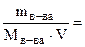
= 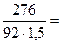 2 моль/л = 2·103 моль / м3;
2 моль/л = 2·103 моль / м3; 
Отсюда: Pосм = 2·10 моль/м3·8, 31 Па·м3/моль· К·265, 5К = 4413·103 Па = 4413 кПа.
Изменение коллигативных свойств растворов с изменением концентрации используется на практике: для понижения температуры замерзания жидкостей (например, антифризы - растворы-теплоносители для охлаждения двигателей), а также для расчета некоторых свойств растворов, растворителей и растворенных веществ. Например, по любому из 4-х свойств можно определить молекулярную массу растворенного вещества.
Пример 4. 0, 25 г нелетучего неэлектролита с неизвестной молекулярной массой растворили в 40 г четыреххлористого углерода CCl4. Температура кипения полученного раствора на 0, 357 ОС выше, чем у растворителя (CCl4). Вычислите молекулярную массу растворенного вещества (КЭ ССl4 = 5, 3).
Решение. Поскольку речь идет о повышении температуры кипения раствора, воспользуемся уравнением (8.2). Из этого уравнения выражаем:
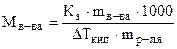 =
= 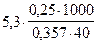 = 92, 8 г/моль.
= 92, 8 г/моль.