
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Эквиваленты окислителя и восстановителя
|
|
При вычислении эквивалентов элементов и их соединений уже указывалось, что их значения определяются характером превращений, которые они претерпевают в химических реакциях. Это положение сохраняет свою силу при вычислении эквивалентов окислителей и восстановителей, поскольку окислительно-восстановительный процесс очень часто протекает различно в зависимости от концентрации окислителя или восстановителя, температуры, среды и т.д.
Эквивалентная молярная масса окислителя и восстановителя определяется делением молярной массы на изменение степени окисления
(на 1 моль вещества) в рассматриваемой реакции.
Например, действуя в качестве восстановителя, HI окисляется солями железа (III) до элементарного йода по реакции
2HI + 2FeCl3 = I2 + FeCl2 + 2HCl.
2I- = I2, Dw = 2,
Fe3+ = Fe2+, Dw = -1.
В этой реакции показатель эквивалентности (Z) восстановителя равен 1 (на 1 моль НI), а его эквивалентная масса Мэк = 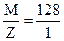 . = 128 (г/моль).
. = 128 (г/моль).
Если же к раствору НI добавить избыток хлорной воды, что приведет к образованию иодноватистой кислоты по реакции:
HI + 3Cl2 + 3H2O = HIO3 + 6HCl
 |
1 I- = I+5 Dw = 6;
3 Cl2 = 2Cl- Dw = –2,
то показатель эквивалентности восстановителя равен 6, то есть
Мэк = = 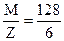 = 21, 33 (г/моль).
= 21, 33 (г/моль).
Пример 8. Определить эквивалентные массы окислителя и восстановителя в реакции:
+6 +4 +3 +6
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
Решение. Окислителем в этой реакции является K2Cr2O7, а восстановителем - Na2SO3.
2Cr+6 + 6ē = = 2Cr3+
S+4 - 2ē = S+6.
Отсюда 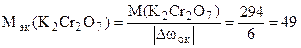 г/моль.
г/моль.
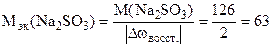 г/моль.
г/моль.