
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Атом құрылысы. Д.И. Менделеевтің периодтық заңы.
|
|
$$$A
Қ ай элементтің иондану энергиясы ең жоғ ары:
А. P
B. Na
C. Mg
D. Al
E. Si
$$$C
Периодтың ең активті металы:
А. F
B. Be
C. Li
D. B
E.O
$$$D
Хром атомының сыртқ ы электроны ү шін квант сандарының n,
l, ml мә ндері:
А. 3, 2, 0
В. 4, 1, 1
С. 3, 2, 1
D. 4, 0, 1
Е. 3, 0, 1
$$$D
Аммиак молекуласында азоттың электрондық бұ лтының
гибридтелуі:
А. sp2
B.dsp2
C.d2sp3
D. sp3
E. sp
$$$B
Иондану энергиясының ең аз мә ні:
А. хлорда
В. цезийде
С. аргонда
D. кальцийде
Е. фосфорда
$$$B
Co3+- ионында неше жұ пталмағ ан иондар бар?
А.3
В.2
С.5
D.6
Е.7
$$$C
Мына иондарғ а: Mn4+, Cl-, Cu+ сә йкес келетін сыртқ ы
электрондық қ абатының конфигурациясы:
А. 3d3, 3S23p6, 3S2
B. 3S23p6, 3d3, 3d10
C. 3d3, 3S23p6, 3d10
D. 3d10, 3S23d10, 3S23p6
E. 3d33S2, 3S23p6, 3S2
$$$C
Қ алыпты жә не қ озғ ан кү йде фосфордың валенттілігі қ ай
мә ндерге тең:
А. І жә неІІІ
В. ІҮ жә не Ү
С. ІІІ жә не Ү
D. ІІІ жә не ІҮ
Е. ІІ жә не Ү
$$$B
Иондану энергиясы ең азы:
А. бромда
В. калийде
С. мырышта
D.мыста
Е. кү місте
$$$C
Мына электрондық формула ең типті металл емеске сә йкес ке-
леді:
А. … 3S1
B. …2S22p1
C…2S22p5
D…. 4S24p6
E. 1S1
$$$C
Элементтің ортақ электрон жұ бын ө зіне қ арай ығ ыстыра
aлатын қ асиеті:
А. иондану энергиясы
В. иондану потенциалы
С. электртерістік
D. электрон қ осылғ ыштық
Е. коваленттік деп аталады.
$$$C
5d- дең гейше толтырылғ ан соң, қ ай дең гейше электрондармен
толтырыла бастайды:
А. 5p
B. 4f
C. 6p
D.6s
E.4s
$$$C
Мына иондарғ а: Mn+4, Cl-, Cu+ сә йкес келетін сыртқ ы элек-
трондық қ абаттың конфигурациясы:
А. 3d3 ; 3s23p6; 3s2
B. 3s23p6; 3d3; 3d10
C. 3d3; 3s23p6; 3d10
D. 3d10; 3s23d10; 3s23p6
E. 3d10; 4s2; 4p6
$$$E
Егер ион қ ұ рамында 18 электрон жә не 16 протон болса, онда
ион заряды мына санғ а тең болады:
А. –18
В. –16
С.+16
D. +2
Е.-2
$$$D
2р – дең гейшедегі электрондардың максимал саны:
А. 1
В. 2
С. 8
D. 6
Е. 4
$$$A
Темір атомында электрондық дең гей:
А. 4
В.6
С.8
D.2
Е.3
$$$A
Мына электрондық формула: 1s22s22p63s2 қ ай металл
атомының гидроксидіне сә йкес:
А.Mg(OH)2
B. NaOH
C. Cu(OH)2
D. KOH
E. Zn(OH)2
$$$A
Темір Fe5526 атомының ядросында протондар мен
нейтрондар:
А. 26 жә не 29
В. 55 жә не 26
С. 26 жә не 55
D. 29 жә не 26
Е. 26 жә не 26
$$$A
Реттік нө мірі 13-ке тең атомның сыртқ ы электрондық қ аба-
тындағ ы электрон саны:
А. 3
В.13
С.27
D.14
Е.10
$$$A
Мына иондарда N3- жә не Al+3 неше электрон болады:
А. 10
В. 14
С.27
D.13
Е.7
$$$A
Реттік нө мірі 15-ке тең атомда барлығ ы неше р- электрондар
бар:
А.9
В.15
С.10
D.3
Е.8
$$$A
Қ озбағ ан хром атомының жұ пталмағ ан электрондарының
cпиндерінің қ осындысы (SmS):
А.3
В.0
С.2
D.5/2
Е.3/2
$$$B
Бас квант саны n = 3 атомның барлық орбиталдарының
қ осындысы:
А.6
В.14
С.4
D.12
Е.16
$$$B
Егер элементтің сыртқ ы энергетикалық дең гейінің қ ұ рылымы
… 5s25p3 болса, оның жоғ арғ ы жә не тө менгі тотығ у дә режелері
А. +5; 0
B.+5; -3
C. +5; -2
D. +3; -3
E.+3; -1
$$$E
Егер элементтің сыртқ ы энергетикалық дең гейінің қ ұ рылымы
… болса, мына элементтің электрон қ осқ ыштығ ы жоғ ары бо-
лады:
А.4s24p4
B. 3s23p3
C. 2s22p6
D. 5s25p5
E. 4s24p5
$$$D
Егер элементтің сыртқ ы энергетикалық дең гейінің қ ұ рылымы
… болса, мына элементтің иондану энергиясы тө мен болады:
А. 3s23p6
B. 3s1 C. 2s2
D. 4s1
E. 3s23p1
$$$A
Егер элементтің электрондық формуласы 1s22s22p3 болса,
мына формулағ а сә йкес қ осылыста атом тө менгі тотығ у
дә режесін кө рсетеді:
А. Н3Э
В. Н4Э2
С. ЭН2ОН
D.Э2О
Е.НЭО2
$$$B
Қ алыпты жә не қ озғ ан кү йдегі фосфор жұ пталмағ ан электрон-
дары арқ ылы (спин-валенттік) мына валенттілікті кө рсетеді:
А. 1; 5
B.3; 5
C.3; 4
D.1; 4
E.4; 5
$$$A
Бор атомының максимал валенттілігі:
А.3
В.5
С.4
D.1
Е.2
$$$B
Қ алыпты жағ дайда хром атомының электрондық формуласы:
А. … 3d4 4s2
B. … 3d54s1
C. … 3d24s24p1
D. …4s24p4
Е. дұ рыс жауабы жоқ
$$$C
3d- дең гейше толтырылғ ан соң, қ ай дең гейше электрондармен
толтырыла бастайды:
А.5p
B.4f
C.4p
D.4s
E.3d
$$$A
Fe3+- ионында неше жұ пталмағ ан иондар бар?
А.3
В.2
С.5
D.6
Е.7
$$$B
Мына элементтердің қ айсысының иондану энергиясының
мә ні жоғ ары:
А. 3Li
B. 9F
C.26Fe
D.53I
E.11Na
$$$D
5 электрон d-дең гейшесін толтырса, спиндер қ осындысы:
А.1/2
В.3/2
С.4/2
D.5/2
Е.6/2
$$$E
Катодты сә улелер дегеніміз:
A. радиоактивті сә улелер ағ ыны
B. Y-сә улелер ағ ыны
C. a-сә улелер ағ ыны
D. нейтрондар ағ ыны
E. электрондар ағ ыны
$$$D
Атомдағ ы электрондар қ озғ алысын зерттеу ү шін қ ай заң пайдаланылады:
A. Кулон заң ы
B. Ом заң ы
C. Ньютон заң ы
D. Кванттық механика заң ы
E. Массалар ә сер заң ы
$$$C
Де-Бройль тең деуін кө рсет:
A. E = m× c2
B. Э = A/B
C. l = h/mv
D. P = CRT
E. Dg × Dv ³ h/m.
$$$A
Кванттық механика нені зенрттейді:
A. микробө лшектер қ озғ алысын
B. металдар қ асиетін
C. макроденелер ә рекеттесуін
D. электролиттер қ асиетін
Е. бейметалдар қ асиетін
$$$E
Теріс зарядталғ ан бө лшектер болып табылатын бө лшекті кө рсет:
A. фотондар
B. гамма-кванттар
C. протондар
D. гравитондар
E. электрондар
$$$C
р-дең гейшедегі орбитальдар саны:
A. 1
B. 2
C. 3
D. 4
E. 5
$$$A
3 d-дең гейшеден кейін толтырылатын дең гейше:
A. 4p
B. 4f
C. 5s
D. 5p
E. 4s
$$$D
d-дең гейшедегі орбитальдар саны:
A. 1
B. 2
C. 3
D. 5
E. 7
$$$E
s-дең гейшедегі орбитальдар саны:
A. 7
B. 5
C. 4
D. 3
E. 1
$$$C
f-дең гейшедегі орбитальдар саны:
A. 14
B. 10
C. 7
D. 3
E. 1
$$$A
s-дең гейшедегі максимальді электрон саны:
A. 2
B. 3
C. 6
D. 10
E. 14
$$$D
d-дең гейшедегі максимальді электрон саны:
A. 2
B. 3
C. 6
D. 10
E. 14
$$$B
4 р-дең гейшеден кейін толтырылатын дең гейше:
A. 6s
B. 5s
C. 4f
D. 3d
E. 5p
$$$E
Бас квант саны нені сипаттайды:
A. электрондардың ө з осі бойынша айналуын
B. орбитальдардың кең істікте орналасуын
C. дең гейшедегі орбиталь пішінін
D. дең гейшедегі электрон энергиясын
E. атомдағ ы электрондар энергиясының жалпы қ орын
$$$C
Дең гейшедегі максимальді элекктрон санын қ ай формуламен есептейді:
A. 2n2
B. n +1
C. 2 (21+1)
D. 2 (n+1)
E. 2 (n+m)
$$$A
Орбитальді квант санының қ абылдайтын мә ні:
A. 0- ден …(n-1) дейін
B. 1- ден … шексіздікке дейін
C. –0, 1; +1.
D. 0-ден … шексіздікке дейін
E. 0, 1, 2, …
$$$B
Бас квант санынын қ алай белгілейді:
A. s
B. n
C. l
D. ms
E. ml
$$$A
Атомның планетарлы моделін ұ сынғ ан:
A. Резерфорд
B. Томпсон
C. Планк
D. Менделеев
E. Бор
$$$A
1s2, 2s2 электрондық формула сә йкес келетін ионды кө рсет:
A. N+3
B. C-4
C. Be+2
D. B+3
E. O-2
$$$D
Сыртқ ы дең гейінің электрондық конфигурациясы 4s2, 4р5 болатын атом:
A. Mn
B. Fe
C. Cu
D. Br
E. Se
$$$C
Кү кірттің қ озғ ан атомының жұ птаспағ ан электрон саны:
A. 2
B. 4
C. 6
D. 5
E. 1
$$$D
Химиялық элементтер қ асиеттері немен периодтық тә уелділікте болады:
A. протондар массасымен
B. нейтрондар мө лшерімен
C. энергетикалық дең гейлер санымен
D. олардың атомдарының ядро зарядымен
E. валенттілікпен
$$$D
Периодтық жү йедегі период номері мынағ ан сә йкес келеді:
A. ядро зарядына
B. орбитальдар мө лшеріне
C. дең гейшелер санына
D. дең гейлер санына
E. атомдағ ы электрондар мө лшеріне
$$$B
Периодтық жү йедегі элементтердің реттік номері мынағ ан тең:
A. валенттілікке
B. ядро зарядына
C. тотығ у дә режесіне
D. дең гейлер санына
E. нетрондар мө лшеріне
$$$A
5 периодтың, атом радиусы неғ ұ рлым ү лкен болатын элементін кө рсет:
A. Rb
B. Mo
C. Pd
D. Ag
E. J
$$$A
5 периодтың, иондану энергиясы ең томен болатын элементін кө рсет:
A. Rb
B. Te
C. J
D. Ag
E. V
$$$E
Периодтық жү йедегі ең активті металл:
A. К
B. Са
C. Na
D. Rb
E. Fr
$$$C
6-шы топ элементтерінің ішіндегі электртерістілігі негұ рлым жоғ ары элемент:
A. Mo
B. Te
C. O
D. Po
E. S
$$$C
Ковалентті байланыс тү зілуінің донорлы-акцепторлы механизмі жү зеге асқ ан молекуланы кө рсет:
A. НСl
B. СН4
C. NH4Cl
D. CO2
E. BeH2
$$$E
Иондық байланысы бар молекула:
A. NO
B. HCl
C. H2O
D. O2
E. K2O
$$$B
Ковалентті полюсті байланысы бар молекула:
A. N2
B. H2O
C. H2
D. Cl2
E. Fe
$$$D
Қ ай молекулағ а sp3- гибридтену тә н:
A. НС1
B. ВеС12
C. NH3
D. CH4
E. BH3
$$$A
МО (молекулалық орбитальдар) ә дісі тұ рғ ысынан Н2 ионындағ ы байланыстар
қ атынасы мынағ ан тең:
A. 0, 5
B. 1
C. 2
D. 1, 5
E. 2, 5
$$$C
NH3 молекуласына қ андай байланыс тә н:
A. сутектік
B. ковалентті полюссіз
C. ковалентті полюсті
D. иондық
E. донорлы-акцепторлық
$$$A
СаF2 молекуласына қ андай байланыс тә н:
A. иондық
B. ковалентті полюсті
C. ковалентті полюссіз
D. донорлы-акцепторлы
E. сутектік
$$$E
Қ андай типті байланысы бар болса, қ осылдыстарда байланыс энергиясы неғ ұ рлым жоғ ары болады:
A. ковалентті полюссіз
B. ковалентті полюсті
C. металддық
D. сутектік
E. иондық
$$$E
Диполь-молекула:
A. Н2
B. О2
C. І2
D. N2
E. НСІ
$$$E
Полюстену ә сері неғ ұ рлым жоғ ары ион:
A. Na+
B. K+
C. Ca+2
D. Ba+2
E. Al+3
$$$D
Қ ай элемент атолмдары сутектік байланыстар тү зе алады:
A. С
B. І
C. Не
D. О
E. Те
$$$E
Байланысқ а бос орбиталін беретін атом:
A. катион
B. анион
C. ион
D. донор
E. акцептор
C
Электрон бұ лтының бағ ытымен (ориентациясымен) сипатталатын квант саны:
А. бас квант саны
В. орбиталь квант саны
C. магнит квант саны
D. спин квант саны
Е. қ осалқ ы квант саны
B
Элементтердің қ асиеттері мынағ ан периодтық тә уелділікте болады:
А. атом массасына
В. элемент атомының ядро зарядына
С. нейтрон санына
D. энергетикалық дең гейлер санына
Е. валентносттілікке
E
Валентті электрондық қ абатының қ ұ рылысы 5s25p5 болатын атом:
А.In
В. Sn
С. Sb
D. Fe
Е. I
A
Атом радиусы кішкентай болатын, 5 период элементі
А.Rb
В. Mo
С. Pd
D. Ag
Е. I
D
Полярлы ковалентті байланысы бар, полярлы емес молекула мысалы:
А.N2
В. H2O
С. NH3
D. CCI4
Е. H2S
C
АО мү мкін болатын гибридтенуін кө рсетің із:
А.3р жә не 4s
В. 4s жә не 5р
С. 4s жә не 4р
D. 3s жә не 4р
Е. 3s, 4р жә не 5d
B
Элементтің жұ птаспағ ан электрон санынан артық, байланыс тү зе алу қ абілетін былай тү сіндіруге болады:
А.ядро зарядымен
В. берілген дең гейде бос ұ яшық тар болғ ан жағ дайда, электрон жұ птарының бө ліну мү мкіндігімен:
С. байланыс энергиясымен
D. d-дең гейшесінің болуымен
Е. АО гибридтелуімен
B
Де Бройль тең деуі:
А.Е=mc2
В. 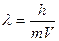
С. E=hn
D. DqDV> 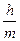
Е. N=2n2
A
3d-дең гейшесінен кейін толтырылатын дең гейшені кө рсетің із:
А. 4р
В. 4f
С. 5s
D. 5р
Е. 4s
A
Қ озғ ан жағ дайдағ ы кө міртегі атомының влентті орбитальдарының толтырылу схемасы:
| А. | | | | | В. | ¯ | | | С. | | ¯ | | | |||||||||||||||
| 2s | 2p | 2s | 2p | 2s | 2p | |||||||||||||||||||||||
| D. | | ¯ | | | Е. | ¯ | ¯ | | ||||||||||
| 2s | 2p | 2s | 2p |
A
Бесінші периодтың ең активті металы:
А. Rb
В. Mo
С. Ag
D. Sn
Е. Te
B
ВF3 молекуласындағ ы бор атомының валентті орбитальдары мына тип бойынша гибридтелген:
А. sp
В. sp2
С. sp3
D. dsp2
Е. d2sp3
C
ВС (валентті байланыстар) ә дісі кө зқ арасынан, фосфор атомының тү зетін ковалентті байланыстарының максимальді санын кө рсетің із:
А.3
В. 4
С. 5
D. 6
Е. 7
E
3 энергетикалық дең гейдегі электрондардың максимальді санын кө рсетің із:
А. 6
В. 8
С. 10
D. 14
Е. 18
D
Периодтық системадағ ы электронтартқ ыштығ ы ең жоғ ары элемент:
А. Не
В. Ве
С. N
D. F
Е. O
A
Периодтық системада элементтің реттік номері мынағ ан сә йкес келеді:
А. ядро зарядына
В. дең гей санына
С. сыртқ ы энергетикалық дең гейдегі электрон санына
D. сыртқ ы қ ұ рылып бітпеген энергетикалық дең гейдегі электрон санына
Е. атом массасына
A
Ә рекеттесетін атомдардың (АО) атомдық орбитальдардың орталық тарын қ осып, бір сызық бойымен бү ркелуі кезінде тү зілетін байланыс:
А.s-байланыс
В. p-байланыс
С. екі s-байланыс
D. екі p-байланыс
Е. екі s жә не p байланыс
D
АО d2sp3гибридтелу кезіндегі, гибридтелген орбитальдардың саны жә не олардың формасы тө мендегідей болады:
А. 3-ү шбұ рыш
В. 4-жазық квадрат
С. 4-тетраэдр
D. 6-октаэдр
Е. 2- сызық ты
A
Изотоп-дегеніміз ол, тө мендегі ерекшелігі бар атомдар:
А. протон саны бірдей
В. нейтрон саны бірдей
С. массасы бірдей
D. сыртқ ы энергетикалық дең гейінде электрон саны бірдей
Е. нуклон саны бірдей
E
f-дең гейшесіндегі орбитальдар саны мынағ ан тең:
А. 3
В. 4
С. 5
D. 6
Е. 7
B
Фтор (F-) ионының электрондық конфигурациясы:
А. 1s22s22p5
В. 1s2s2 2p6
С. 1s22s22p4
D. 1s22s22p53s1
Е. 1s22s22p7
C
р-орбитальдарының кең істіктегі бағ ытының (ориентациясының) саны:
А. 1
В. 2
С. 3
D. 4
Е. 5
A
Хунд ережесі бойынша d-дең гейшедегі электрондардың таралуы:
| А. | | | | | | В. | ¯ | | | | С. | ¯ | ¯ | | | |||||||||||||
| D. | | | ¯ | | | Е. | ¯ | | ¯ | | ||||||||
C
Иондық жә не ковалентті байланыстарғ а тә н жалпы қ асиеттер:
А. қ анық қ андық
В. бағ ытталғ ыштық
С. полюстену
D. қ анық қ андық жә не полюстену
Е. бағ ытталғ ыштық жә не полюстену
C
Атомдағ ы 2р-дең гейшеден кейін толтырылатын дең гейшені кө рсет:
А.3d
В. 3p
С. 3s
D. 2s
Е. 4s
C
Дипольдік моменті нө лге тең болатын зат молекуласын кө рсет:
А. H2S
В. NH3
С. N2
D. H2O
Е. OF2
C
Толық электрондық аналог- бола алатын элементтерді кө рсет:
A. Be, Zn
В. Cu, Zn
B. Zn, Ba