
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
C. Zn, Cd
|
|
Е. Ba, Hg
C
Химиялық байланысының иондық сипаты неғ ұ рлым айқ ын кө рініп тұ рғ ан, атомдар жұ бы:
A. F-F
В. O-F
B. K-F
C. P-F
Е. H-F
C
АО (атомдық орбитальдардың) бү ркелуі кезінде тү зілетін s-байланыс:
A. Py -Py
В. S -PX
C. dxy -dxy
D. Pz- Pz
Е. dxy-dxy
C
P+5 ионындағ ы протондар жә не электрондар саны :
A.15p жә не 15e-
В.15p жә не 10e-
C.10p жә не 15e-
D.20p жә не 15e-
Е.10p жә не 10e-
C
Ядро зарядының ө суімен, солдан оң ғ а қ арай бір жә не сол бір периодтың элементтер қ атарында электртерістілік:
A. ө згермейді
В. кемиді
C. артады
D. кіші периодтарда артады, ал ү лкен периодтарда кемиді
Е. кіші периодтарда кемиді, ал ү лкен периодтарда артады
C
s- жә не р-элементтердің ә рекеттесуі кезінде тү зілуі мү мкін болатын химиялық байланыс:
А. ковалентті полюсті
В. ковалентті полюссіз
C. иондық
D. сутектік
Е. донорлық -акцепторлық
D
Атомның гибридтелген орбитальдарына тә н форма: 1. біркелкі форма,
2. ә ртү рлі формалар, 3.біркелкі энергия, 4. ә ртү рлі энергиялар, 5. жоғ ары энергиялар, 6. байланыс беріктігі, 7. Байланыс беріктігінің кемуі.
A. 1, 2, 7
В. 1, 4, 5
B. 2, 4, 5
C. 1, 3, 6
E. 1, 3, 7
D
ВС (валентті байланыстар) ә дісінің кө зқ арасы жағ ынан, екінші период элементтерінің тү зетін ковалентті байланыстарының максимальді саны тө мендегіден артық болмайды:
A.1
B. 2
C. 3
D. 4
E. 6
E
Планк тең деуі:
A. DqDV³ 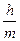
В. N=2n2
C. Е=mc2
D. 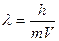
Е. E=hn
D
Электрондық формуласы -1s22s22p63s23p63d104s1 болатын атом:
A. K
В. Br
C. Cr
D. Cu
Е. Zn
A
Периодтық системадағ ы, атом радиусы ең кішкентай элемент:
A. Н
В. Не
C. Li
D. Ne
Е. Fr
C
Қ андай жағ дайда АО гибридизациясы мү мкін болмайтынын кө рсет:
A. 2s жә не 2p
B. 3s, 3p, 3d
C. 3p жә не 4s
D. 4s, 4p, 4d
Е. 4s, 4p
D
Валентті байланыстар кө зқ арасы жағ ынан ковалентті байланыстың келесі қ асиетіне нә тижесінде Н2 молекуласы тү зіледі, бірақ Н3 тү зілмейді:
А. бағ ытталғ андық жә не қ анық қ андық
B. қ анық қ андық жә не полюстену
C. полюстену
D. қ анық қ андық
Е. байланыс энергиясы
C
Су молекуласының ассоциация тү зү і тө мендегі қ асиеттермен тү сіндіріледі:
А. байланыстың қ анық пауы
B. ковалентті байланыстың тү зілуімен
C. сутектік байланыстың тү зілуімен
D. молекуланың полюстілігімен
Е. оттегінің электртерістілігімен
C
Бас жә не орбиталь квант сандарының суммасы (n+l=5) беске тең болатын орбитальді кө рсет:
A. 3s
B. 3p
C. 3d
D. 4d
Е. 4f
B
Ядросында 19 протоны жә не 20 нейтроны бар элементтің атомдық массасын анық та:
A. 19
B. 39
C. 20
D. 38
Е. 40
D
Оттегі атомындағ ы орбитальдар санының суммамсы мынығ ан тең:
A. 2
B. 3
C. 4
D. 5
Е. 6
A
Ионизациялану энергиясы ядро зарядының ө суімен элементтер қ атарында жоғ арыдан тө мен қ арай:
А. кемиді
B. артады
C. ө згермейді
D. негізгі қ атарларда артады
Е. заң дылық жоқ
D
Электрондық аналогтар болатын элементтерді кө рсет:
A. N, P, S, CI
B. O, S, CI
C. S, CI, Ar
D. N, P, As
Е. O, S, N
D
Байланысқ а атомдық орбитальін беретін атом тө мендегідей аталады:
A. катион
B. анион
C. донор
D. акцептор
Е. ион
C
Ең тө мен энергиялы орбитальді кө рсет:
A. 3s
B. 3p
C. 2p
D. 3d
Е. 4s
A
Екінші ретті периодтылық деп:
A. топшалардағ ы элементтер қ асиеттерінің монотонды емес ө згеруі
B. топшалардағ ы элементтер қ асиеттерінің монотонды ө згеруі
C. топтардағ ы металдық қ асиеттердің ө згеруі
D. топшалардағ ы бейметалдық қ асиеттердің ө згеруі
Е. бұ л тү сініктің мә ні жоқ
A
Негізгі топшаларды қ ұ райтын элементтер:
А. s жә не р-элементтер
B. s жә не d-элементтер
C. s жә не f-элементтер
D. р жә не d-элементтер
Е. р жә не f-элементтер
E
Химиялық байланыстың тү зілуі кезінде қ андай энергетикалық эффект орын алады:
А. энергия сің ірілуі
B. энергия ө згермейді
C. заң дылық жоқ
D. тек қ ана иондық байланыс тү зілуі кезінде
Е. энергия бө лінеді
E
Тө мендегі байланыстардың қ андай типіне неғ ұ рлым жоғ ары энергия тә н:
А. ковалентті
B. ковалентті полюсті
C. ковалентті полюссіз
D. металлдық
Е. иондық
B
Иондық байланыстың қ асиеттерін кө рсет (толық жауапты таң дау қ ажет):
1. қ анық қ андық, 2. бағ ытталғ андық, 3. қ анық пағ андық, 4. бағ ытталмағ андық, 5. полюстену.
A. 1, 2
B. 3, 4, 5
C. 4, 5
D. 1, 2, 5
Е. 1, 3, 5
D
Қ озбағ ан кү йдегі атомнан электронды жұ лып алуғ а жұ мсалатын энергия тө мендегідей аталады:
A. электрон тартқ ыштық
B. электртерістілік
C. байланыс энергиясы
D. бірінші ионизациялану энергиясы
Е. электроң дылық
B
Бір атомның электрон жұ бы жә не екінші бір атомның бос орбитальдарының ә рекеттесуі нә тижесінде тү зілетін химиялық байланыс тө менднгідеі аталады:
A. ковалентті полюсті
B. ковалентті байланыстың донорлық -акцепторлық механизмі
C. иондық
D. металлдық
Е. ковалентті полюссіз
E
Қ осымша топшалар қ ұ рамына кіретін элементтер:
A. s-элементтер
B. р-элементтер
C. s- жә не р-элементтер
D. s- жә не d-элементтер
Е. d-элементтер