
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химиялық процесстердің энергетикасы.Химиялық кинетика,химиялық тепе-теңдік
|
|
$$$B
Қ оршағ ан ортамен энергиясымен жә не заттарымен алмасатын жү йе:
A. оқ шауланғ ан жү йе деп аталады
B. ашық жү йе деп аталады
C. жабық жү йе деп аталады
D. гомогенді жү йе деп аталады
E. гетерогенді жү йе деп аталады
$$$B
Мына реакцияда FeS+HNO3®Fe(NO3)2+S+NO2+H2O
неше моль HNO3 (конц.) қ атысады:
А. 10
В.4
С.8
D.7
Е.6
$$$C
Мына реакция ү шін 2HF+O3=H2O+F2+O2 Гибсс энергиясы
(кДж/моль) DGHF= -269, 9 кДж/моль; DGHO= -237, 3 кДж/моль:
А. –252, 4
В.139, 3
С.302, 5
D.5, 7
Е.14, 3
$$$C
Мына реакция ү шін 2HF+O3=H2O+F2+O2 Гибсс энергиясы
(кДж/моль) DGHF= -269, 9 кДж/моль; DGHO= -237, 3 кДж/моль:
А. –252, 4
В.139, 3
С.302, 5
D.5, 7
Е.14, 3
$$$B
Егер оттегінің концентрациясын 3 есе арттырса, мына реакция-
ның 4HCl + O2 = 2 Cl2 + 2H2 жылдамдығ ы қ алай ө згереді?
А. 7 есе артады
В. 3 есе артады
С. 3 есе азаяды
D. 6 есе артады
Е. 5 есе артады
$$$D
Мына реакция ү шін 2А + 2В = С ә рекеттесетін заттардың біреуінің концентрациясын 3 есе арттырса, ал температураны 300С – қ а тө мендетсе (g = 2), реакция жылдамдығ ы қ алай ө згереді?
А. 2 есе артады
В. 3 есе азаяды
С. 8 есе азаяды
D. 1, 1 есе артады
Е. 4 есе кемиді
$$$B
Егер оттегінің концентрациясын 3 есе арттырса, мына реакция-
ның 4HCl + O2 = 2 Cl2 + 2H2 жылдамдығ ы қ алай ө згереді?
А. 7 есе артады
В. 3 есе артады
С. 3 есе азаяды
D. 6 есе артады
Е. 5 есе артады
$$$B
Мына тепе- тең декті оң ғ а ығ ыстыру ү шін FeO + H2 = Fe + H2O(г)
А. FeO жә не H2 концентрацияларын кө бейтеді
В. Н2 концентрациясын жә не қ ысымын кө бейтеді
С. Реакция нә тижесінде тү зілген заттардың концентрациясын
кө бейтіп
D. FeO концентрациясын кө бейтіп
Е. Н2О концентрациясын кө бейтіп
$$$C
Егер қ ысымды арттырса, мына тепе-тең дік қ ай жақ қ а ығ ысады:
СО(г) + Н2О(г) = СО2 (г) + Н2 (г)
А. оң ғ а
В. солғ а
С. тепе-тең дік бұ зылмайды
D. дұ рыс жауабы жоқ
Е. оң ғ а, сосын солғ а
$$$C
H2 + I2 ® 2HI реакциясы ү шін мына концентрацияларда
[Н2] = 0, 3 моль/л; [I2] = 0, 08 моль/л; [HI] = 0, 35 моль/л тепе-
тең дік орнағ ан. Тепе-тең дік константасын есепте.
А. 14, 59
В.18, 24
С.36
D. 0, 08
Е.5, 1
$$$B
Тү зілу энтальпиясы нольге тең заттар:
A. НСІ, СО
B. О2, СІ2
C. СН4, СаО
D. РН3, КОН
E. НІ, Na2O
$$$D
Химиялық термодинамика нені зерттейді:
A. реакция ретін
B. реакция жылдамдығ ын
C. реакцияның молекулалығ ын
D. реакция энергиясының ө згеруін
E. қ айтымсыз реакцияларды
$$$B
Гиббс энергиясының ө згеруі қ ай формуламен есептеледі:
A. DG = T × DG
B. DG = DH - TDS
C. DG = T × DS - DH
D. DG = DH
E. DG = DH + DS
$$$A
Қ оршағ ан ортамен тек қ ана энергиясымен алмасатын жү йе:
A. жабық жү йе деп аталады
B. ашық жү йе деп аталады
C. оқ шауланғ ан жү йе деп аталады
D. гомогенді жү йе деп аталады
E. қ айтымды жү йе деп аталады
$$$B
Оқ шауланғ ан жү йелерде ө здігінен жү ретін процесстер мына бағ ытта жү реді:
A. энтропияның тө мендеуі
B. энтропияның жоғ арылауы
C. энтропияның нольге ұ мтылуы
D. энтропияның біртексіз ө згеруі
E. энтропияның ө згеруінде заң дылық жоқ
$$$B
Мына реакцияғ а (аА + вВ = сС + дД) массалар ә сер заң ының математикалық тең деуі қ алай ө рнектелген:
A. Р = CRT
B. v = k CaA. CвВ
C. Dtзам = K. Cm
D. Dtкип = E. Cm
E. E = h v
$$$E
Температураны 200 (g =2) тө мендетсе, реакция жылдамдығ ы да тө мендейді:
A. 2 есе
B. 6 есе
C. 8 есе
D.16 есе
E. 4 есе
$$$D
Мына реакция (Н2+СІ2 =2НСІ) жү ретін жү йеде қ ысымды 2 есеге арттырғ ан. Реакция жылдамдығ ы неше есе артады:
A. 3 есе
B. 6 есе
C. 8 есе
D. 4 есе
E. 27 есе
$$$B
Тепе-тең дік константасын қ ай формуламен есептейді:
A. К = kпр. + kобр.
B. K = kпр. /kобр.
C. K = kпр. × kобр.
D. K = kпр. – kобр.
E. K = kобр.
$$$A
Мына реакцияда (N2+3H2 = 2NH3) қ ысымның тө мендеуіне байланысты реакция тепе-тең дігі қ ай жақ қ а ығ ысады:
A. солғ а
B. оң ғ а
C. ешқ айда ығ ыспайды
D. заң дылық жоқ
E. тепе-тең дік орнамайды.
$$$E
Реакция жылдамдығ ына ә сер етпейтін фактор:
A. концентрация
B. температура
C. катализатор
D. ә рекеттесетін заттар табиғ аты
E. кө лем
$$$D
Температураны 300 жоғ арылатқ анда реакция жылдамдығ ы 8 есе артты. Температуралық коэффициентті есепте:
A. 9
B. 8
C. 6
D. 2
E. 1
$$$D
Мына реакцияда (N2+3H2 = 2NH3+ 92, 0 кДж,) тепе-тең дікті аммиак тү зілу жағ ына қ арай ығ ыстыру ү шін не істеу керек:
A. қ ысыммен температураны тө мендету керек
B. қ ысымды тө мендетіп, ал температураны жоғ арылату керек
C. қ ысымды да, температураны да жоғ арылату керек
D. қ ысымды жоғ арылатып, ал температураны тө мендету керек
E. сутегінің корнцентрациясын тө мендету керек
$$$E
Мына реакцияда (2NOг. +O2 г. = 2NOг.) қ ысымның 2 есе жоғ арылауымен байланысты реакция жылдамдығ ы:
A. 6 есе артада
B. 6 есе кемиді
C. 8 есе артады
D. 16 есе кемиді
E. 27 есе артады.
$$$D
Қ ай жағ дайда тепе-тең дік орнайды:
A. vпр. = vобр. DG < O
B. vпр. > vобр. DG = O
C. vпр. < vобр. DG > O
D. vпр. = vобр. DG = O
E. vпр. = vобр. DH > O
$$$C
Гомогенді реакцияның жылдамдық константасы осы реакцияның сандық мә ніне қ андай жағ дайда тең болады:
A. егер ә ректтесуші заттар концентрациясы нө льге тең болса
B. катализатора қ атысында
C. егер ә рекеттесуші заттар концентрациясы 1 моль/л тең болса
D. егер t = 2980 K
E. егер Еакт. = 1.
$$$A
Температураны ә рбір 100 кө терген сайын, Вант-Гофф ережесі бойынша реакция жылдамдығ ы неше есе артады:
A. 2-4 есе
B. 15-18 есе
C. 12-14 есе
D. 5-7 есе
E. 2-8 есе
$$$D
Жү йедегі температураны (g =2) 200 –тан 400-қ а дейін кө терді, реакция жылдамдығ ы неше есе артты:
A. 32 есе
B. 16 есе
C. 12 есе
D. 4 есе
E. 2 есе
$$$C
Мү мкін болатын термодинамикалық реакцияның жылдамдығ ын ө згертіп, ал бірақ ө здері реакция барысында ө згеріссіз қ алатын заттар:
A. индикаторлар деп аталады
B. регуляторлар деп аталады
C. катализаторлар деп аталады
D. промоторлар деп аталады
E. константалар деп аталады
$$$E
Тепе-тең дік жағ дайда тұ рғ ан жү йеге қ андай да бір жағ даймен ә сер етсе (мысалы t, Р, C-ны ө згертсе), онда тепе-тең дік осы ә серді ә лсірететін бағ ытқ а қ арай ығ ысады. Бұ л заң:
A. массалар ә сер заң ы
B. зат массасының сақ талу заң ы
C. энергия сақ талу заң ы
D. Гесс заң ы
E. Ле-Шателье принципі
$$$B
Химиялық реакция нә тижесінде бө лінетін немесе сің ірілетін жылу:
A. жү йенің ішкі энергиясы деп аталады
B. реакцияның жылу эффектісі деп аталады
C. жү йенің энтропиясы деп аталады
D. Гиббс энергиясы деп аталады
E. жуйенің кинетикалық энергиясы деп аталады
$$$E
Жү йенің энтальпиясы арта жү ретін химиялық реакциялар қ алай аталады:
A. нейтралдай реакциясы
B. алмасу реакциясы
C. тотығ у-тотық сыздану реакциясы
D. экзотермиялық реакциялар
E. эндотермиялық реакциялар
D
Қ оршағ ан ортамен энергиясымен жә не массасымен ауысатын жү йе тө мендегідей аталады:
А. гомогенді
B. жекеленген
C. гетерогенді
D. ашық
Е. тұ йық
D
Химиялық реакциы жылдамдығ ы немен анық талады:
A. ә рекеттесетін заттардың моль санымен
B. бө лшектердің соқ тығ ысу санымен
C. бө лшектердің активті соқ тығ ысу санымен
D. бір кө лемде бір уақ ыт ішінде реакцияғ а қ атысатын заттардың моль с.нымен
Е. реакция ө німінің моль санымен
B
Вант-Гофф заң ы бойынша осмостық қ ысым тө мендегіге тура пропорционал:
А. зат эквивалентіне
B. молярлы концентрацияғ а жә не температурағ а
C. электрө ткізгіштікке
D. процентті концентрацияғ а
Е. иондар қ озғ алғ ыштығ ына жә не температурағ а
D
Ішкі энергия, энтальпия, энтропия, температура нені білдіреді:
А. энергетикалық сипаттамалар
B. ауыспалы қ асиеттер
C. заттардың тұ рақ ты қ асиеттері
D. кү й функциясы
Е. жекеленген жү йені сипаттайтын шамалар
A
Реакцияның молекулярлығ ы деп нені атайды:
А. реакцияның элементарлы актіне қ атысатын молекулалар саны
B. реакция нә тижесінде тү зілген молекулалар саны
C. соқ тығ ысқ ан молекулалар саны
D. ә рекеттесуші заттар жә не реакция ө німі молекулаларының санының суммасы
Е. бұ л реакция тә ртібі
D
Тү зілу энтальпиясының стандартты мә ніне сү йене отырып, неғ ұ рлым тұ рақ ты қ осылысты кө рсет:
A. D Н0AgCl=-127, 1 кДж/моль
B. D Н0Н2О=- -285, 8 кДж/моль
C. D Н0НCl=-92, 3 кДж/моль
D. D Н0AL2O3=-1676 кДж/моль
Е. D Н0Al=-0 кДж/моль
C
Химиялық тепе-тең діктің ығ ысуына не ә сер етпейді:
A. зат концентрациясы
B. температура
C. катализатор
D. қ ысым
Е. қ ысым жә не концентрация
C
Химиялық реакция жылдамдығ ы неге тә уелсіз:
A. концентрацияғ а
B. температурағ а
C. катализаторғ а
D. рітінді кө леміне
Е. ә рекеттесуші заттар табиғ атына
C
Тұ рақ ты температурадағ ы қ айтымсыз процесстер ү шін термодинамиканың ІІ заң ының математикалық тең деуін кө рсет:
A. 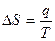
B. 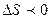
C. 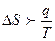
D. 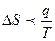
Е. 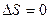
C
Катализді қ ай жағ дайда гомогенді деп атайды:
A. ә рекеттесуші заттар жә не катализатор - газдар
B. ә рекеттесуші заттар жә не катализатор - сұ йық тық тар
C. ә рекеттесуші заттар жә не катализатор бір фазада
D. ә рекеттесуші заттар жә не катализатор ә ртү рлі фазада
Е. катализатор қ атты зат
B
Жекеленген жү йедегі процесстер тө мендегі бағ ыт бойынша ө здігінен жү ре бастайды (термодинамиканың ІІ заң ы):
A. энтропияның кемуі
B. энтропияның артуы
C. энтропия нө лге тең
D. энтропи ү немі ө згеріп отырады
Е. энтропияның біртіндеп кемуі
E
Мына процессте хлор шығ ымын қ алай кө бейтуге болады:
4НСl(г) + О2 (г) Û 2Сl2 (г) + 2Н2О(г)
A. оттегі концентрациясын кеміту
B. температураны арттыру
C. қ ысымды азайту
D. қ ысымды азайту жә не температураны арттыру
Е. қ ысымды арттыру
D
Реакция жылдамдығ ының константасы тө мендегіге тә уелді:
A. концентрацияғ а
B. концентрацияғ а, температурағ а
C. концентрацияғ а жә не реагенттер табиғ атына
D. температурағ а, ә рекеттесуші заттар табиғ атына
Е. еріткіш табиғ атына
D
Кальций фосфаты, кальций оксиді, фосфорлы ангидрид қ осылыстарының тү зілу жылуы DН0298 осығ ан сә йкес: -4137, 5 кДж/моль, -635, 5 кДж/моль, -1492 кДж/моль. Реакцияның жылу эффектісін есепте:
3 СаО(к) + Р2О5(к) = Са3(РО4)2 (к)
A. –3502кДж
B. –2127кДж
C. –2010, 5кДж
D. –739кДж
Е. +739кДж
$$$C
Егер температураны 300С –қ а кө тергенде, реакция жылдамдығ ы 27 есе артқ ан, реакцияның температуралық коэффициентін анық та:
A. 9
B. 2
C. 3
D. 2, 7
Е. 2, 2
$$$B
Реакцияның температуралық коэффициенті тө мендегі мә ндерді қ абылдай алады:
A. 10-нан 100-ге дейін
B. 2-ден 4-ке дейін
C. 2-ден 10-ғ а дейін
D. 0-ден 4-ке дейін
Е. 0-ден 10-ғ а дейін
$$$C
Катализатор тө мендегілердің қ айсысына ә сер етпейді:
A. реакция жылдамдығ ына
B. реакция энергиясының активациясына
C. реакцияның жылу эффектісіне
D. ә рекеттесуші заттар концентрациясына
Е. кері реакция жылдамдығ ына
$$$B
Кү й функциясына тә н қ асиеттер:
A. ауыспалы мә н
B. ө згеріс ө ту жолына тә уелсіз
C. жағ дайғ а тә уелді белгілі бір мә н
D. ө згеріс уақ ыт ішінде ү здіксіз
Е. тұ рақ ты мә н
$$$E
Қ ысымды 2 есе арттырғ анда тура реакция жылдамдығ ы 2СО(Г)=СО2(Г)+С(ТВ) тө мендегідей ө згереді:
A. 2 есе артады
B. 3 есе артады
C. 4 есе азаяды
D. 6 есе артады
Е. 4 есе артады
$$$D
Молекуланың немесе ионның активтілігі деп:
A. ион немесе молекула энергиясы
B. олардың концентрациясы
C. реакцияғ а қ атыса алу қ абілеті
D. олардың химиялық реакцияда соғ ан сә йкес ә сер ететін концентрациясы
Е. заттар концентрациясы
$$$B
Гиббстің еркін энергиясы тө мендегі қ атынаспен анық талады:
A. H=U+PV
B. G=H-TS
B. H=q
D. S= 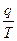
Е. S> 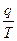
$$$A
Тұ рақ ты қ ысымда, химиялық реакцияларда сің ірілетін немесе бө лінетін жйлу ө лшемі қ алай аталады:
A. энтальпия
B. энтропия
C. Гиббстің еркін энергиясы
D. потенциал
Е. энергия
$$$B
3, 2г кү кірт жанғ анда 27, 9 кДж жылу бө лінеді, SO2 тү зілу
жылуын есепте (кДж):
А. 27, 9
В. 279
С. 87, 64
D.6, 9
Е. 4, 6
$$$C
80г Fe2O3 кө міртегі (ІІ) оксидімен толық тотық сызданғ анда
13, 4 кДж энергия бө леді, Fe2O3 – тің DН298 есепте:
А. –13, 4
В.13, 4
С.-26, 8
D. 52, 8
Е.70