
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Закон Максвела для розподілу молекул ідеального газу за швидкостями та енергіями теплового руху
|
|
функція розподілу молекул за швидкостями f( v ). Ця величина визначає відносне число молекул,
швидкості яких лежать в інтервалі від υ до υ + d υ, тобто  де N – число усіх молекул.
де N – число усіх молекул.
Молекули в газі, здійснюючи хаотичний рух, весь час стикаються між собою. Якщо газ знаходиться у стані термодинамічної рівноваги (Т =const), то встановлюється деякий стаціонарний, не змінний з часом розподіл молекул за швидкостями, який підкоряється цілком певному статистичному закону. Цей закон був теоретично виведений Максвеллом на основі теорії імовірностей.
Максвелл при виведенні розподілу молекул за швидкостями виходив з наступного:
1. Газ складається з великого числа N однакових молекул.
2. Температура газу постійна.
3. Молекули газу здійснюють тепловий хаотичний рух.
4. Внаслідок хаотичного руху молекул всі напрями руху
рівноімовірні, тобто в будь-якому напрямі в середньому рухається
однакове число молекул.
5. На газ не діють силові поля.
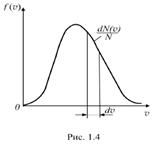
Графік функції (1.21) наведений на рис. 1.4. Функція f( υ ), починаюється в нулі, досягає максимуму, а потім асимптотично прямує до нуля. Відносне число молекул, швидкості яких лежать в інтервалі від υ до υ + d υ, знаходиться як площа відокремленої смужки.
 Остаточно розподіл молекул за швидкостями з урахуванням
Остаточно розподіл молекул за швидкостями з урахуванням
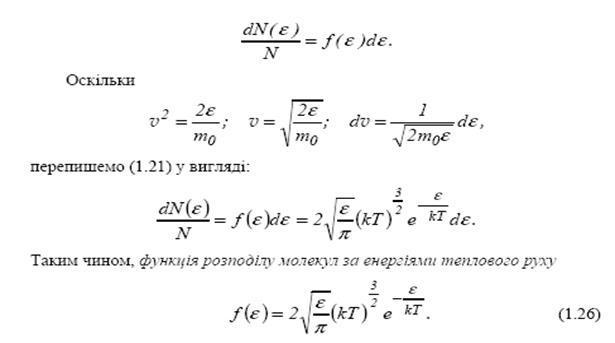 коефіцієнта А:
коефіцієнта А:  звідки випливає, що конкретний вид функції залежить від роду газу (від маси молекул) і від температури.
звідки випливає, що конкретний вид функції залежить від роду газу (від маси молекул) і від температури.
14.1Розпотіл молекул газу за енергіями. З 1.22=>