
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Приведите примеры, иллюстрирующие правило выравнивания полярностей Ребиндера.
|
|
Ответ
1.Правило выравнивания полярностей фаз Ребиндера: вещества из раствора тем лучше адсорбируются на адсорбенте, чем больше разность полярностей между адсорбентом и растворителем. Адсорбат, сорбируясь на границе раздела фаз, уравнивает полярность фаз, т.е. снижается поверхностная энергия при адсорбции ПАВ, пропорциональная разности полярностей фаз. Процесс адсорбции идет в сторону выравнивания полярностей и тем интенсивнее, чем больше разность полярностей.
2. Неполярные адсорбенты (уголь, алмаз, графит, парафин, тальк) хорошо адсорбируют из полярных растворителей (H2O) различного ряда неполярные вещества (спирты, карбоновые кислоты, фенолы). Полярность адсорбата должна быть промежуточной между полярностью среды и адсорбента. Чем она меньше, тем больше величина адсорбции на неполярном адсорбенте. Следовательно, чем больше длина углеродной цепи адсорбата, тем больше величина адсорбции вещества из полярного растворителя (рис.1). Так, на рис.1 видно, что при равных условиях (равновесная концентрация растворенного вещества С) величина адсорбции (Г) возрастает с увеличением длины углеродной цепи
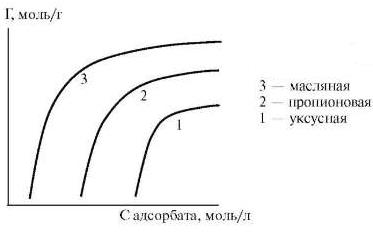
Рис. 1. Изотермы адсорбции на неполярном адсорбенте для гомологического ряда жирных кислот: СН3-СООН уксусная кислота; СН3-СН2-СООН пропионовая кислота; СН3-(СН2)2-СООН масляная кислота
3. Правило выравнивания полярностей Ребиндера является основой для практических рекомендаций по адсорбции ПАВ:
1) для извлечения ПАВ из полярного растворителя (например Н 2 О) следует при менять неполярный адсорбент (например, уголь). Ориентация молекул ПАВ на такой границе раздела будет следующей: полярная часть ориентируется к полярной фазе. В результате адсорбции снижается разность полярностей, так как поверхность угля становится более полярной.
2) для извлечения ПАВ из неполярного растворителя (например, бензола), нуж но выбирать полярный адсорбент (например, силикагель).
3) сочетание адсорбента и растворителя одинаковой полярности препятствует адсорбции ПАВ, т.к. отсутствует разность полярностей и условий для ад сорбции нет.
15. На каких границах раздела возможна: а)положительная, б)отрицательная адсорбция? В чем это выражается и можно ли это подтвердить экспериментально?
Ответ
1. Понятия положительной и отрицательной адсорбции связаны с понятием адсорбции Гиббса. Адсорбция по Гиббсу – это разность между числом молей данного вещества в объеме V, прилегающем к поверхности и в таком же объеме V вдали от поверхности. В зависимости от соотношения количеств вещества в приповерхностном слое и в объеме раствора адсорбция Гиббса может быть положительной (Г> 0) и отрицательной (Г< 0). Положительная адсорбция выражается в накоплении растворенного вещества в приповерхностном слое, отрицательная – в понижении концентрации растворенного вещества на границе раздела фаз. Положительная и отрицательная адсорбции возможны в любой двухфазной системе: несмешивающиеся жидкости, жидкость с газом (или паром), жидкость -твердые вещества, газ(пар)- твердые вещества.
2. Наиболее распространены исследования положительной и отрицательной адсорбции на границе «воздух-раствор». Это обусловлено относительно легким определением такой характеристики адсорбции, как поверхностное натяжение σ. Поверхностное натяжение растворов, как правило, определяется по методу Ребиндера. Между адсорбцией вещества на границе «воздух-раствор» и поверхностным натяжением раствора σ существует связь, описываемая фундаментальным уравнением изотермы адсорбции Гиббса
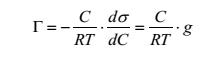
где Г - адсорбция, выраженная как избыток вещества в поверхностном слое водного раствора, С – концентрация растворенного вещества в моль/л. Поверхностная активность 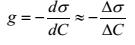 отражает изменение поверхностного натяжения раствора с изменением концентрации. Из уравнения следует, что если g > 0, то Г > 0, а при g < 0 возникает дефицит вещества на поверхности и Г < 0. Вещества, снижающие поверхностное натяжение воды, т.е. проявляющие положительную адсорбцию, называются поверхностно-активными веществами (ПАВ). Для растворов поверхностно-инактивных веществ (ПИВ) обратные знаки:
отражает изменение поверхностного натяжения раствора с изменением концентрации. Из уравнения следует, что если g > 0, то Г > 0, а при g < 0 возникает дефицит вещества на поверхности и Г < 0. Вещества, снижающие поверхностное натяжение воды, т.е. проявляющие положительную адсорбцию, называются поверхностно-активными веществами (ПАВ). Для растворов поверхностно-инактивных веществ (ПИВ) обратные знаки: 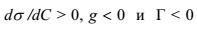 и Г < 0 (отрицательная адсорбция). К ПАВ относятся органические кислоты, спирты, кетоны, амины и другие органические вещества, которые имеют полярные или гидрофильные группы (ОН-, COOH-, NH2-) и неполярный или гидрофобный/липофильный радикал, например, R = CH3 (CH2)n. Вследствие своей дифильности молекулы ПАВ ориентируются в поверхностном слое следующим образом: полярные группы находятся в поверхностном слое полярного растворителя (воды), а углеводородная цепь обращена в воздух. При увеличении концентрации ПАВ поверхностное натяжение
и Г < 0 (отрицательная адсорбция). К ПАВ относятся органические кислоты, спирты, кетоны, амины и другие органические вещества, которые имеют полярные или гидрофильные группы (ОН-, COOH-, NH2-) и неполярный или гидрофобный/липофильный радикал, например, R = CH3 (CH2)n. Вследствие своей дифильности молекулы ПАВ ориентируются в поверхностном слое следующим образом: полярные группы находятся в поверхностном слое полярного растворителя (воды), а углеводородная цепь обращена в воздух. При увеличении концентрации ПАВ поверхностное натяжение 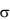 снижается, а в насыщенном молекулами ПАВ адсорбционном слое (монослое) значение
снижается, а в насыщенном молекулами ПАВ адсорбционном слое (монослое) значение 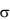 приближается к значению
приближается к значению 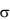 ПАВ чистого вещества. Неорганические кислоты, основания и соли являются поверхностно-инактивными веществами(ПИВ). Распространенный пример ПИВ- хорошо диссоциирующие в воде соли неорганических кислот. Образующиеся ионы сильно гидратируются, т.к. элек-тростатическое взаимодействие ион/диполь сильнее взаимодействия молекул воды по механизму диполь/диполь. Поэтому ионы оттягиваются от поверхности раствора и реальное повышение поверхностного натяжения наблюдается лишь при очень высоких их концентрациях, часто близких насыщению.
ПАВ чистого вещества. Неорганические кислоты, основания и соли являются поверхностно-инактивными веществами(ПИВ). Распространенный пример ПИВ- хорошо диссоциирующие в воде соли неорганических кислот. Образующиеся ионы сильно гидратируются, т.к. элек-тростатическое взаимодействие ион/диполь сильнее взаимодействия молекул воды по механизму диполь/диполь. Поэтому ионы оттягиваются от поверхности раствора и реальное повышение поверхностного натяжения наблюдается лишь при очень высоких их концентрациях, часто близких насыщению.
3. При исследованиях адсорбции на поверхности твердых тел гораздо проще измерять непосредственно избыточные или полные величины адсорбции. В этом случае измерения поверхностного натяжения проводятся крайне редко из-за отсутствия простых методик, неоднородности поверхности и т.д.
________________________________________________________________________
16.Напишите формулу мицеллы золя, полученного сливанием 80 см3 раствора сульфата натрия с молярной концентрацией эквивалента 0, 006 моль\дм3 и 50 см3 раствора хлорида бария с молярной концентрацией эквивалента 0, 02 моль\дм3