
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Строение белковой молекулы.
|
|
Молекула белков имеет вид длинных цепей, которые состоят из 50-1500 аминокислот, соединенных прочной ковалентной азот-углеродной связью, называемой пептидной связью (– СО – NH –), а образовавшееся соединение называется пептидом.
H 
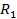 O
O
\ ׀ ׀ //
N———C———C———N———C———C
/ ׀ ׀ ׀ ׀ ׀ \
H H  H OH
H OH
свободная пептидная свободная
аминогруппа связь карбоксильная группа
Из 2х аминокислот образуется дипептид (димер); из 3х аминокислот – трипептид(триммер); из многих – полипептид (полимер).
Кроме пептидной связи известна еще дисульфидная связь, которая формируется при взаимодействии двух остатков аминокислоты цистеина. (– S – S –)
Поскольку в аминокислотах одновременно присутствуют и  (основная группа) и COOH (кислая группа), они относятся к амфотерным соединениям.
(основная группа) и COOH (кислая группа), они относятся к амфотерным соединениям.
Выделяют 4 уровня пространственной организации молекулы белков.
 Первичная структура белка – полипептидная цепочка с определенной последовательностью аминокислот («линейная цепочка»)
Первичная структура белка – полипептидная цепочка с определенной последовательностью аминокислот («линейная цепочка»)
Первичная структура белка уникальна и определяет его пространственную организацию, свойства и функции в клетке. Пример: белок рибонуклеаза, выполняющий ферментативную функцию.
Вторичная структура белка определяется укладкой цепочки аминокислот в определенные структуры, называемые α - спиралью и β - слоем (гармошка).
Вторичная структура формируется за счет: ионных и электростатических связей между положительными и отрицательными ионами; и водородных связей, которые образуются между двумя сильно отрицательными атомами – С и О.
Пример: кератин – входит в состав ногтей и волос, коллаген также фермент в формуле закрученной спирали.
Третичная структура образуется при сворачивании полипептидной цепи с элементами вторичной структуры в клубок (глобулу) и поддерживается за счет ионных, гидрофильных и ковалентных (дисульфидных) связей между различными остатками аминокислот.
Гидрофильные связи – это связи образующиеся за счет дисперсионных взаимодействий полярных боковых цепей.
Гидрофобные связи – слабые связи между неполярными боковыми цепями, возникающие в результате взаимного отталкивания молекулярного растворителя.
Биологическую активность белок проявляет только в виде третичной структуры, поэтому замена даже одной аминокислоты в цепочке может привести к изменению конфигурации белка и к снижению или утрате его биологический активности.
Четвертичная структура белка – объединение 2х, 3х, 4х и более молекул с третичной организацией в один комплекс.
Пример: гемоглобин состоит из 4х субъед. и небелковой части – гема (железа).
Замена одной из 300 аминокислот, находящихся в молекуле гемоглобина – глутаминовой кислоты – валином, изменяет свойства гемоглобина. Люди с такими изменениями страдают наследственными заболеваниями – серповидноклеточной анемией.
Все цепи в четвертичной структуре удерживаются слабыми связями типа водородных и дисульфидных мостиков.
Денатурация – утрата белковой молекулой своей структурной организации.
Денатурация может происходить в результате различных химических и физических факторов (обработка спиртом, ацетоном, кислотами, повышение температуры, облучение, высокое Д и т.д.)
Денатурация может быть:
ü обратимой –нарушается четвертичная, третичная и вторичная структура белка, но первичная НЕ нарушается, и при возвращении нормальных условий вожможна ренатурация – восстановление нормальной конфигурации белковой молекулы.
ü необратимой – при нарушении первичной структуры.