
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Соединения галогенов с кислородом. Фториды кислорода. Оксиды хлора, йода, брома, их структура, свойства и применение.
|
|
Непосредственно с кислородом галогены не соединяются. Кислородосодержащие соединения получаются косвенным путем. В основе получения кислородных соединений галогенов лежат реакции с водой и щелочами. Из кислородсодержащих соединений галогенов наиболее устойчивы соли кислородных кислот, наименее— оксиды и кислоты. Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительную степень окисления, достигающую семи.
Фториды кислорода - соединения, содержащие связь О—F, например дифторид OF2, монофторид (диоксофторид) O2F2, нитрат фтора FNO3, перхлорат фтора FClO4. Фтор с кислородом образует в тлеющем разряде смесь стабильных радикалов F—O—O и атомов фтора; при конденсации этой смеси при —96°С образуются высшие фториды кислорода — O2F2, O3F2 и др., стабильные лишь при низких температурах.
Все фториды кислорода обладают сильной окислительной способностью.
Оксиды хлора — неорганические химические соединения хлора и кислорода, общей формулой: ClхOу.
Оксид хлора (I), гемоксид хлора, ангидрид хлорноватистой кислоты — соединение хлора в степени окисления+1 с кислородом, жёлто-коричневый газ.
Получение.
Получают взаимодействием газообразного хлора с оксидом ртути (метод Пелуза). Реакция в зависимости от условий может протекать двумя различными путями, но во всех случаях с образованием искомого оксида хлора:

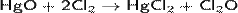
Образующийся Cl2O конденсируют при температуре − 60 °C. При более высокой температуре соединение разлагается со взрывом.
Другой крупнотоннажный способ - реакция газообразного хлора с влажным Na2CO3 в башенных или во вращающихся трубчатых реакторах:
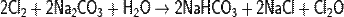
Также водный раствор может быть получен хлорированием карбонатов щелочных или щёлочноземельных металлов в воде.
Свойства.
В нормальных условиях представляет собой буровато-жёлтый газ с характерным запахом, напоминающим запах хлора. При температурах ниже 2 °C — жидкость золотисто-красного цвета. Ядовит: поражает дыхательные пути. Самопроизвольно медленно разлагается:
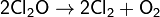
При больших концентрациях взрывоопасен. Плотность при нормальных условиях 3, 22 кг/м³. Растворяется в четырёххлористом углероде. Хорошо растворим в воде с образованием слабой хлорноватистой кислоты:
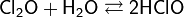
Диоксид хлора — неорганическое химическое соединение хлора и кислорода, формула: ClO2.
Получение
В лаборатории диоксид хлора получают по реакции хлората калия с щавелевой кислотой:

Из-за взрывоопасности диоксид хлора невозможно хранить в виде жидкости. Однако адсорбирование на поверхности силикагеля позволяет хранить диоксид хлора при пониженной температуре достаточно долго, а также избавиться от примесей хлора, силикагелем не поглощающегося.
Промышленный метод получения ClO2 основан на реакции восстановления хлората натрия диоксидом серы:

Свойства
Кислотный оксид. При растворении в воде образуются хлористая и хлорноватая кислоты (реакция диспропорционирования). Разбавленные растворы устойчивы в темноте, на свету медленно разлагаются:

Образующаяся хлористая кислота очень неустойчива и разлагается:
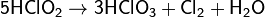
ClO2 реагирует со многими органическими соединениями и выступает окислителем средней силы. Большинство реакций с участием ClO2 протекают по механизму одноэлектронного окисления с образованием органических катион-радикалов и хлорит-иона на первой стадии реакции, но возможно протекание и других реакций, в частности, реакции отрыва атома водорода.
Оксид хлора(VI) — бинарное соединения хлора и кислорода с формулой Cl2O6. Представляет собой ярко-красную жидкость. В твёрдом состоянии является кристаллическим веществом оранжевого цвета. Молекулы жидкого оксида хлора(VI) имеют строение  , кристаллического —
, кристаллического — 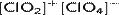 .
.
Оксид хлора(VI) получают окислением диоксида хлора озоном:

Свойства.
Оксид хлора(VI) является нестойким веществом и начинает разлагаться уже при температурах 0-10 °C
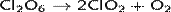
При температурах выше 20 °C в продуктах распада появляется хлор.
С водой реагирует бурно — со вспышкой, при этом продуктами реакции являются хлорноватая и хлорная кислоты:
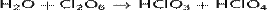
Взаимодействует с водой и щелочами в растворе, при этом проходит реакция диспропорционирования:
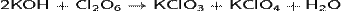
Проявляет сильные окислительные свойства:
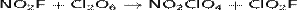
СAlCl3 образует ClO2[Al(ClO4)4], с FeCl3 — ClO2[Fe2(ClO4)7].
Окси́ д хло́ ра(VII) (дихлорогептаоксид) Cl2O7, (хлорный ангидрид) — кислотный оксид. Высший оксид хлора, в котором он проявляет степень окисления +7.
Молекула Cl2O7 имеет строение О3Cl—О—ClO3 (dCl—О = 0, 1709 нм, в группах ClО3 — 0, 1405 нм, угол ClOCl = 118, 6°, ОClO 115, 2°) c пространственной симметрией C2, молекула полярна (μ = 2, 40·10− 30 Кл·м).
Свойства.
Хлорный ангидрид представляет собой бесцветную маслянистую жидкость. Cl2O7 взрывается при нагревании выше 120 °C и от удара, однако он более устойчив, чем оксид и диоксид хлора. Жидкий Cl2О7 устойчив до 60—70 °C, но примесь низших оксидов хлора существенно ускоряет его распад:
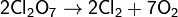 Δ H = 135 кДж/моль
Δ H = 135 кДж/моль
Медленно растворяется в холодной воде, образуя хлорную кислоту:
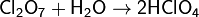
Хлорный ангидрид является сильным окислителем.
Получают Cl2О7 при осторожном нагревании хлорной кислоты с фосфорным ангидридом или олеумом:

Оксид хлора(VII) получают также электролизом раствора НClО4 на платиновых электродах ниже 0 °C (Cl2O7накапливается в анодном пространстве). Чистый Cl2O7 можно синтезировать также при нагревании в вакууме некоторых перхлоратов, например, Nb(ClO4)5 или МоО2(ClO4)2.
Оксид брома(I) — неорганическое соединение брома и кислорода с формулой Br2O, неустойчивые тёмно-коричневые кристаллы при температуре ниже -18°С.
Получение:
· Действие брома на оксид ртути:

· Разложение в вакууме диоксида брома:
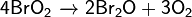
Физические и химические свойства:
· Оксид брома(I) образует неустойчивые тёмно-коричневые кристаллы при температуре ниже -18°С, которые плавятся с разложением.
· Является сильным окислителем:

· Реагирует с щелочами:
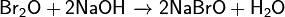
Диоксид брома (оксид брома(IV)) — неорганическое соединение брома и кислорода с формулой BrO2, неустойчивые светло-жёлтое твёрдое вещество, существующее при температурах ниже − 40°С.
Получают действием озона на бром при низкой температуре:

Физические свойства.
Диоксид брома образует неустойчивые светло-жёлтое твёрдое вещество, существующее при температурах ниже − 40°С.
Молекула имеет строение BrOBrO3.
Термически неустойчиво при температуре выше − 40°С.
Химические свойства.
· Разлагается при осторожном нагревании в вакууме с образованием оксида брома(I):
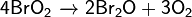
· Реагирует с щелочами:

Оксид йода(V), йодноватый ангидрид - белое твердое вещество, единственный термодинамически устойчивый из оксидов галогенов. Твердый оксид I2O5. Может быть получен при осторожном нагревании НIO3 до 200°С, порошок. При нагревании выше 300°С распадается на иод и кислород, проявляет окислительные свойства, в частности используется для поглощения CO в анализе:
5СО + I2O5 = I2 + 5CO2.
49. Кислородсодержащие кислоты хлора – хлорноватистая, хлористая, хлорноватая, хлорная и их соли – получение, свойства.
Хлор образует четыре кислородсодержащие кислоты: хлорнотистую, хлористую, хлорноватую и хлорную.
Хлорноватистая кислота НСlO образуется при взаимодействии хлора с водой, а также ее солей с сильными минеральными кислотами. Она относится к слабым кислотам, очень неустойчива. Состав продуктов реакции ее разложения зависит от условий. При сильном освещении хлорноватистой кислоты, наличии в растворе восстановителя, а также длительном стоянии она разлагается с выделением атомарного кислорода:
НСlO = HСl + O
В присутствии водоотнимающих веществ образуется оксид хлора (I):
2 НСlO = 2 Н2О + Сl2O
Cl2О можно считать ангидридом хлорноватистой кислоты. При нагревании хлорноватистая кислота разлагается с образованием двух кислот — соляной и хлорноватой:
3 НСlO = 2 НСl + НСlO3
Поэтому при взаимодействии хлора с горячим раствором щелочи образуется соли не соляной и хлорноватистой, а соляной и хлорноватой кислот:
6 NаОН + 3 Сl2 = 5 NаСl + NаСlО3 + 3 Н2О
Соли хлорноватистой кислоты — г и п о х л о р и т ы — очень сильные окислители. Они образуются при взаимодействии хлора со щелочами на холоду. Одновременно образуются соли соляной кислоты. Из таких смесей наибольшее распространение получили хлорная известь и жавелевая вода.
Хлорная, или белильная, известь СаОСl2, или СаСl(СlO), образуется при взаимодействии хлора с порошкообразным гидроксидом кальция — пушенкой:
Са(ОН)2 + Сl2 = Cl-O-Ca-Cl + H2O
или
2 Са(ОН)2 + 2 Сl2 = СаСl2 + Са(ОСl)2 + 2 Н2О
Качество хлорной извести определяется содержанием в ней гипохлорита. Она обладает очень сильными окислительными свойствами и может окислять даже соли марганца до перманганат:
5СаОСl2 +2Mn(NО3)2 +3Са(ОН) =Са(МпO4)2+5СаСl2+2Са(NО3)2+ 3H2O
Под действием углекислого газа, содержащегося в воздухе, она разлагается с выделением хлора:
СаОСl2 + СО2 = СаСО3 + Сl2
или
СаСl2 + Са(ОСl)2 + 2 СО2 = 2 СаСО3 + 2 Сl2
Хлорная известь применяется как отбеливающее и дезинфицирующее вещество.
Хлористая кислота НСlO2 образуется при действии концентрированной серной кислоты на хлориты щелочных металлов, которые получаются как промежуточные продукты при электролизе растворов хлоридов щелочных металлов в отсутствие диафрагмы между катодным и анодным пространствами. Это слабая, неустойчивая кислота, очень сильный окислитель в кислой среде. При взаимодействии ее с соляной кислотой выделяется хлор:
НСlO2 + 3 НС1 = Сl2 + 2 Н2О
Хлориты натрия используются для получения диоксида хлора, при обеззараживании воды, а также какотбеливаюший агент.
Хлорноватая кислота НСlO3 образуется при действии на ее соли — хлораты — серной кислоты. Это очень неустойчивая кислота, очень сильный окислитель. Может существовать только в разбавленных растворах. При упаривании раствора НСlO3 при низкой температуре в вакууме можно получить вязкий раствор, содержащий около 40 % хлорной кислоты. При более высоком содержании кислоты раствор разлагается со взрывом. Разложение со взрывом происходит и при меньшей концентрации в присутствии восстановителей. В разбавленных растворах хлорная кислота проявляет окислительные свойства, причем реакции протекают вполне спокойно:
НСlO3 + 6 НВr = НСl + 3 Вr2 + 3 Н2О
Соли хлорноватой кислоты — хлораты — образуются при электролизе растворов хлоридов в отсутствие диафрагмы между катодным и анодным пространствами, а также при растворении хлора в горячем растворе щелочей, как показано выше. Образующийся при электролизе хлорат калия (бертолетова соль) слабо растворяется в воде и в виде белого осадка легко отделяется от других солей. Как и кислота, хлораты — довольно сильные окислители:
КСlO3 + 6 НСl = КСl + 3 Сl2 + 3 Н2О
Хлораты применяются для производства взрывчатых веществ, а также получения кислорода в лабораторных условиях и солей хлорной кислоты — п е р х л о р а т о в. При нагревании бертолетовой соли в присутствии диоксида марганца МпО2, играющего роль катализатора, выделяется кислород. Если же нагревать хлорат калия без катализатора, то он разлагается с образованием калиевых солей хлороводородной и хлорной кислот:
2 КСlО3 = 2 КСl + 3 O2
4 КСlO3 = КСl + 3 КСlO4
При обработке перхлоратов концентрированной серной кислотой можно получить хлорную кислоту:
КСlO4 + Н2SO4 = КНSO4 + НСlO4
Это самая сильная кислота. Она наиболее устойчива из всех кислород содержащих кислот хлора, однако безводная кислота при нагревании, встряхивании или контакте с восстановителями может разлагаться со взрывом. Разбавленные растворы хлорной кислоты вполне устойчивы и безопасны в работе. Хлораты калия, рубидия, цезия, аммония и большинства органических оснований плохо растворяются в воде.
В промышленности перхлорат калия получают электролитическим окислением бертолетовой соли:
2 Н+ + 2 е- = Н2 (на катоде)
СlО3- - 2 е- + Н2О = СlO4- + 2 Н+ (на аноде)
50. Бромноватистая, йодноватая, метапериодная, ортопериодная кислоты и соли – их свойства и применения. Применение галогенов и их соединений.
Бромноватистая кислота — сложное неорганическое соединение брома, водорода и кислорода с химической формулой HBrO. Представляет собой слабую кислоту; образует соли — гипобромиты. Получается при реакции брома с водой под действием света:

Неустойчивая кислота. Известна только в водном растворе с концентрацией не выше 30 %. При стоянии разлагается:

Сильный окислитель (E = 1, 59 В).
Иодноватая кислота HIO3 — бесцветное кристаллическое вещество, со стеклянным блеском и горьковато-кислым вкусом, устойчивое при обычной температуре. Легко образуется в кристаллическом состоянии в виде двух различных, не переходящих друг в друга форм ромбической сингонии.
Иодноватая кислота хорошо растворима в воде, в концентрированных растворах проявляется её склонность к полимеризации и устанавливается равновесие:

При медленном нагревании она частично плавится при 110оС, частично образует ангидроиодноватую кислоту HI3O8.
При нагревании HIO3 до 230 °C образуется порошок иодноватого ангидрида, обладающего сильными окислительными свойствами, – I2O5, который растворяется в воде, вновь образуя иодноватую кислоту:
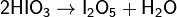
Иодноватая кислота — сильная одноосновная кислота, обладает окислительными свойствами: E 0(HIO3/I2) = 1, 19 В.

Соли иодноватой кислоты называют иодатами. Иодаты разлагаются только выше 400 °C. Они обладают сильными окислительными свойствами. При взаимодействии с иодидами в кислой среде иодаты выделяют элементный иод.
Получают в водных растворах при окислении иода хлором, пероксидом водорода либо дымящей азотной кислотой:
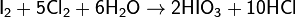
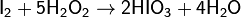
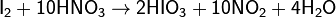
Применение
Природное соединение фтора - криолит Na3AlF6 - применяется при получении алюминия. Соединения фтора используются в качестве добавок в зубные пасты для предотвращения заболеваний кариесом.
Хлор широко используется для получения соляной кислоты, в органическом синтезе при производстве пластмасс и синтетических волокон, каучуков, красителей, растворителей и др. Многие хлорсодержащие соединения используют для борьбы с вредителями в сельском хозяйстве. Хлор и его соединения применяются для отбеливания льняных и хлопчатобумажных тканей, бумаги, обеззараживания питьевой воды. Правда, применение хлора для обеззараживания воды далеко не безопасно, для этих целей лучше использовать озон.
Простые вещества и соединения брома и иода используются в фармацевтической и химической промышленности.