
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая промышленность
|
|
· При производстве аммиака, метанола, мыла и пластмасс.
· В качестве газа-носителя в газовой хроматографии.
Пищевая промышленность
· При производстве маргарина из жидких растительных масел.
· Зарегистрирован в качестве пищевой добавки E949.
Топливо
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей.
Электроэнергетика
Водород применяется для охлаждения мощных электрических генераторов.
46. Фтор, хром, бром, йод. Получение, физические и химические свойства, изменение окислительной активности (в подгруппе). Взаимодействие галогенов с водой и растворами щелочей.
Галоге́ ны — химические элементы 17-й группы периодической таблицы химических элементов Д. И. Менделеева (фтор F, хлор Cl, бром Br, иод I).
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений.
Имея на внешней электронной оболочке 7 электронов, атомы всех галогенов легко присоединяют недостающий до завершения оболочки 1 электрон и в своих соединениях проявляют степень окисления − 1. Хлор, бром, иод в соединениях с более электроотрицательными элементами проявляют положительные степени окисления: +1, +3, +5. Для фтора характерна постоянная степень окисления − 1.
Физические свойства.
| Веще-ство | Агрегатное состояние при обычных условиях | Цвет | Запах |
| Фтор F2 | Газ, не сжижается при обычной температуре | Светло-желтый | Резкий, раздражающий |
| Хлор CI2 | Газ, сжижающийся при обычной температуре под давлением | Жёлто-зелёный | Резкий, удушливый |
| Бром Br2 | Жидкость | Буровато-коричневый | Резкий, зловонный |
| Йод I2 | Твёрдое вещество | Тёмно-серый с металлическим блеском | Резкий |
Фтор
Самый активный неметалл, бурно взаимодействует почти со всеми веществами, кроме фторидов в высших степенях окисления и редких исключений —фторопластов, и с большинством из них — с горением и взрывом, и всеми химическими элементами, кроме гелия, неона и аргона. Ко фтору при комнатной температуре устойчивы некоторые металлы за счёт образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до − 252°C). В атмосфере фтора горят даже вода иплатина:


К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:


Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2.
Во всех соединениях фтор проявляет степень окисления − 1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Получение:
1) Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
2) В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальциясо смазкой из оксида свинца (II) и глицерина.
3) Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хлор
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
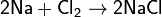

C неметаллами (кроме углерода, азота, фтора, кислорода и инертных газов), образует соответствующие хлориды.

 .
.
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму.

Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде),
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
С кислородом хлор образует оксиды, в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O5, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
При реакции с фтором образуется не хлорид, а фториды:


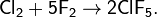
Получение:
1) Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение.
2) Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:

3) В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
