
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Другой способ
|
|
В тех редких случаях, когда сероводород (H2S) вытесняет сульфат(SO4-) из соли (с металлами Cu, Ag, Pb, Hg) побочным продуктом является серная кислота:
 .
.
Сульфиды данных металлов обладают высочайшей прочностью, а также отличительным черным окрасом.
Химические свойства.
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
Окисляет HI и частично HBr до свободных галогенов.


Углерод до CO2, серу — до SO2.

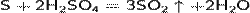
Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta.). При этом концентрированная серная кислота восстанавливается до SO2, например[3]:

На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются и реакции не протекают.
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до S и H2S.
Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например:

Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые —гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.


Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:

Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например:
 .
.
В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3: H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум).
Дисерная кислота - неорганическое соединение с химической формулой H2S2O7.
О́ леум — раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4.
Олеум представляет собой вязкую маслянистую бесцветную жидкость или легкоплавкие кристаллы, которые, однако, могут приобретать самые различные оттенки вследствие наличия примесей. На воздухе «дымит», реагирует с водой с выделением очень большого количества тепла. Олеум по сравнению с концентрированной серной кислотой обладает ещё большим водоотнимающим и окислительным действием. Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
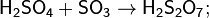

Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98, 3 % H2SO4.
Температура кипения олеума с увеличением содержания SO3 понижается.
Пероксосульфаты (персульфаты) — неорганические соединения, соли пероксо-серных кислот.
Пероксодисульфаты получают электролизом кислых сульфатов:
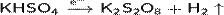
Пероксосульфаты получают из пероксосерной кислоты (Кислота Каро):

так как кислота одноосновная, то она образует только «кислые» соли (но в некоторых литературных источниках упоминаются «средние» соли).
Являются сильными окислителями, например, окисляют ион марганца до перманганата:
 .
.