
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химические свойства. На воздухе сера горит, образуя сернистый газ — бесцветный газ с резким запахом:
|
|
На воздухе сера горит, образуя сернистый газ — бесцветный газ с резким запахом:

С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO[11].
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только софтором:
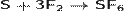
Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов (дихлорид серы и дитиодихлорид)[12]:


При избытке серы также образуются разнообразные дихлориды полисеры типа SnCl2.[13]
При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора[14], среди которых — высший сульфид P2S5:

Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием:
 (сероводород)
(сероводород)
 (сероуглерод)
(сероуглерод)
При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды:

 .
.
Сероводоро́ д (серни́ стый водоро́ д, сульфи́ д водоро́ да, дигидросульфи́ д) — бесцветный газ со сладковатым вкусом, имеющий запах протухших куриных яиц. Бинарное химическое соединение водорода исеры. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. В больших концентрациях ядовит, взаимодействует со многими металлами. Огнеопасен.
Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2).Молекула сероводорода имеет изогнутую форму, поэтому она полярна (μ = 0, 34·10− 29 Кл·м). Сероводород является газом. Раствор сероводорода в воде — очень слабая сероводородная кислота. Является сверхпроводником.
Химические свойства.
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
 K a = 6, 9·10− 7 моль/л; p K a = 6, 89.л
K a = 6, 9·10− 7 моль/л; p K a = 6, 89.л
Реагирует со щелочами:
 (средняя соль, при избытке NaOH)
(средняя соль, при избытке NaOH)
 (кислая соль, при отношении 1: 1)
(кислая соль, при отношении 1: 1)
Сероводород — сильный восстановитель. Окислительно-восстановительные потенциалы:

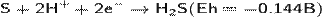
В воздухе горит синим пламенем:

при недостатке кислорода:
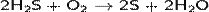 (на этой реакции основан промышленный способ получения серы).
(на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или ион SO42− , например:


Получение.
· Взаимодействием разбавленных кислот с сульфидами:

· Взаимодействие сульфида алюминия с водой (эта реакция отличается чистотой полученного сероводорода):

· Сплавлением парафина с серой.
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов раствора растворимой соли сероводородной кислоты, например, сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для всех щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са² + и Sr2+ очень нестойки. Являясь солями слабой кислоты, в водном растворе растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями (например, Al2S3, Cr2S3 и др.), часто проходит необратимо с выпадением в осадок нерастворимого гидроксида.
41. Соединения серы с кислородом. Диоксид и триоксид серы – получение, свойства, применение .
Все кислородные соединения серы являются экзотермическими.
Оксиды: известны как высшие, так и низшие оксиды серы. К последним относятся такие неустойчивые оксиды, как S2O3 и S2O. Например, S2O образуется в зоне электрического разряда, проходящего в атмосфере SO2, и тут же разлагается:
2 S2O = 3S + SO2,
аналогично диспропорционирует и S2O3
2 S2O3 = S + 3 SO2.
Из высших оксидов серы наиболее изучены SO2 - оксид серы IV (сернистый ангидрид) и SO3 -оксид серы VI (ангидрид серной кислоты).
Оксид серы(IV) SO2 природе встречается в составе вулканических газов и газов, образованных в результате горения природного угля. SO2 — газ с полярной ковалентной связью. В лабораторных условиях SO2 получают путем воздействия на соли сернистой кислоты соляной и серной кислотами:
Na2SO3 + H2SO4 = Na2SO4 + Н2О + SO2↑.
Оксид cepы (IV) получают также путем воздействия на медную стружку концентрированной серной кислотой:
2H2SO4(конц.) + Сu = CuSO4 + SO2↑ + 2Н2О.
В промышленности оксид серы (IV) получают путем обжига на воздухе сульфидов металлов:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑; 2ZnS + 3O2 → 2ZnO + 2SO2↑.
Оксид серы (IV)-бесцветный газе резким удушливым запахом, который при -10°С переходит в жидкое, а при -730C — в твердое состояние. Будучи кислотным оксидом, растворяясь в воде, образует сернистую кислоту:
SO2 + Н2О = H2SO3
Взаимодействуя с основными оксидами и щелочами, оксид cepы(IV) образует сульфиты:
СаО + SO2 = CaSO3; 2NaOH + SO2 → H2O + Na2SO3.
Оксид cepы(IV) окисляется в присутствии катализатора и образует оксид cepы(VI):
2SO2 + O2  2SO3 + Q.
2SO3 + Q.
Оксид cepы(IV) окисляет сульфид водорода, в результате сам восстанавливается до серы:
2H2S + SO2 → 2H2O + 3S↓.
SO2 обесцвечивает органические красители, убивает микроорганизмы, используется при изготовлении сухофруктов (кураги), выращивании ягод. Жидкий SO2 используется при очистке нефти.
Оксид серы (VI) SO3 — высший оксид серы, бесцветная жидкость, кипящая при 45°С, а при 17°С превращающаяся в белую кристаллическую массу. Оксид cepы(VI) проявляет свойства, присущие кислотным оксидам. Легко вступает в реакцию с водой и образует серную кислоту: SO3 + Н2О = H2SO4 + Q.
Сам оксид серы(VI) также хорошо растворяется в концентрированной серной кислоте, при этом образуется олеум: H2SO4 · nSO3:
H2SO4 + nSO3 → H2SO4 · nSO3.
В промышленности оксид серы (VI) получают путем окисления оксида cepы(IV) в присутствии катализатора. Оксид серы (VI) применяется в основном в производстве серной кислоты.
42. Сернистая кислота и ее соли – получение, строение молекулы и свойства. Тиосерная кислот и тиосульфат натрия, получение и свойства.
Сернистая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Отвечает степени окисления серы +4. Химическая формула 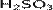 .
.
Сернистую кислоту можно получить посредством растворения сернистого газа (SO2) в воде (H2O).
Химические свойства.
Кислота средней силы:


Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):

Растворы H2SO3 всегда имеют резкий специфический запах химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):

и средние — сульфиты (в избытке щёлочи):

Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:

При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:

Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:

Тиосерная кислота — неорганическое соединение, двухосновная сильная кислота с формулой H2SO3S. Бесцветная вязкая жидкость, реагирует с водой. Образует соли — неорганические тиосульфаты. Тиосерная кислота содержит два атома серы, один из которых имеет степень окисления +4, а второй — электронейтрален.
Получение.
· Реакция сероводорода и триоксида серы в этиловом эфире при низких температурах:

· Действие газообразного хлористого водорода на тиосульфат натрия:

Физические свойства.
Тиосерная кислота образует бесцветную вязкую жидкость, не замерзающую даже при очень низкой температуре. Термически неустойчива — разлагается уже при комнатной температуре.
Быстро, но не мгновенно, разлагается в водных растворах. В присутствии серной кислоты разлагается мгновенно.
Химические свойства.
· Термически очень неустойчива:

· В присутствии серной кислоты разлагается:

· Реагирует со щелочами:

· Реагирует с галогенами:

Образует сложные эфиры — органические тиосульфаты.
Тиосульфа́ т на́ трия (антихлор, гипосульфит, сульфидотриоксосульфат натрия, натрий сернова-тистокислый) — Na2S2O3 или Na2SO3S, соль натрия и тиосерной кислоты, образует кристаллогидрат Na2S2O3·5H2O.
Получение.
· окислением полисульфидов Na;
· кипячение избытка серы с Na2SO3:

· взаимодействием H2S и SO2 с NaOH (побочный продукт в производстве NaHSO3, сернистых красителей, при очистке промышленных газов от S):

· кипячение избытка серы с гидроксидом натрия:

затем по приведённой выше реакции сульфит натрия присоединяет серу, образуя тиосульфат натрия.
Одновременно в ходе этой реакции образуются полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO2.
· чистый безводный тиосульфат натрия можно получить реакцией серы с нитритом натрия в формамиде. Эта реакция количественно протекает (при 80 °C за 30 минут) по уравнению:

· растворение сульфида натрия в воде в присутствии кислорода воздуха:

Физические и химические свойства.
Бесцветные моноклинные кристаллы. Растворим в воде.
При 48, 5 °C кристаллогидрат растворяется в своей кристаллизационной воде, образуя перенасыщенный раствор; обезвоживается около 100оС.
При нагревании до 220 °C распадается по схеме:

Тиосульфат натрия - сильный восстановитель:
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:

Более слабыми или медленно действующими окислителями, например, иодом, переводится в соли тетратионовой кислоты:

Приведённая реакция очень важна, так как служит основой иодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия иодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается:

Расплавленный кристаллогидрат Na2S2O3·5H2O очень склонен к переохлаждению.