
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основна частина
|
|
1.1 Розрахунок рівноважного ступеня перетворення
Вихідними даними для розрахунку є технологічні параметри, за яких відбувається процес: тиск, склад вихідної газової суміші, числове значення константи рівноваги хімічної реакції при ладанних технологічних параметрах. Розрахунок складу рівноважної суміші полягає у визначенні концентрації вихідних речовин і продуктів реакції при досягненні системою стану рівноваги. Суть розрахунку полягає в розв`язанні рівняння закону діючих мас, коли відомі вихідні дані.
Розглянемо реакцію, що відбувається в газовій фазі за стехіометричним рівнянням:
С2Н4+Н2О«С2Н5ОН+Q
Рівняння константи рівноваги цієї реакції має вигляд [1]:
lgKp = -1090/T + 4.71·lgT – 2.35·10-3T – 7.5
lgKp = 2.1486
Kp = 140.7994
У стані рівноваги число молей компонентів буде:
n С2Н4 = 0.552 – 0.448Xp,
n Н2О = 0.448 – 0.448Xp,
n С2Н5ОН = 0 + 0.448Xp,
∑ n = 1 – 0.448Xp,
∆ n = -1.
Дана газофазна реакція відбувається із великою зміною об’єму. Концентрації компонентів (молярні долі) у стані рівноваги (Nі = n / Snі):
N С2Н4 = (0.552 – 0.448Xp)/(1 – 0.448Xp),
N Н2О = 0.448(1 – Xp)/(1 – 0.448),
N С2Н5ОН = 0.448Xp/(1 – 0.448Xp).
Для обчислення Хр підставляємо значення рівноважних концентрацій (з врахуванням того, що парціальний тиск компонента Рі = Ni.P) у рівняння константи рівноваги, та отримуємо рівняння:
140.7994 = (1 – 0.448Xp)/46.9231 · (0.448Xp)/((0.552 – 0.448Xp) · (0.448 – 0.448Xp))
Обчислення Хр із останнього рівняння в середовищі Excel дає значення Xp = 0.9992.
Тоді концентрації компонентів реакції в стані рівноваги:
N С2Н4 = 0.1889,
N Н2О = 6.4885·10-4 ,
N С2Н5ОН = 0.9592.
1.2 Матеріальний розрахунок (баланс) виробництва
Матеріальний баланс хіміко-технологічного процесу (ХТП) - математичне вираження закону збереження маси речовини, відповідно до якого маса всіх видів сировини і матеріалів, що надходять на переробку /прихід/, дорівнює масі отриманих продуктів і втрат /витрати/. Метою матеріального балансу є визначення витратних коефіцієнтів усіх вихідних реагентів за заданою-продуктивністю за цільовим продуктом, а також обчислення складу вихідної суміші і продуктів реакції.
Ґрунтом для матеріальних розрахунків ХТП е рівняння хімічних реакцій (основної та побічних). Результати матеріальних розрахунків використовують як вихідні дані для визначення габаритів реактора.
Для реакції  (1.1)
(1.1)
для заданої кількості GR (кг) цільового продукту практичний витратний коефіцієнт (кг) за компонентом А становить:
 (1.2)
(1.2)
де МА, МR - молярні маси компонентів A і R; X - ступінь перетворення за компонентом А, взятим у нестачі щодо компонента В, частки од.; об’єм компонента А (м3) при цьому становить VAo = GAo /rA, де rA - питома вага компонента А, кг/м3. Вихідні маси Go і об’єм V0 усіх компонентів реакції

 (1.3)
(1.3)
де mAo, NAo масова і об’ємна (молярна) частки речовини А у вихідній суміші відповідно.
Вихідна маса і об’єм речовини В /аналогічно R і S /
GBo = Go. mBo; VBo = NBo .V0, (1.4)
Маса і об’єм продукту S, що утворився у ході реакції,

 , (1.5)
, (1.5)
І нарешті, кількості A, B, R, S після перебігу реакції (3.1)дорівнюють:
GAK = GAo.(1 - X); VAK = VAo.(1 - X) = GAK /rA;

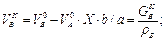


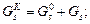

Обчислення об’ємів суміші і компонентів виконують для рідких і газоподібних речовин.
За розділу 1.1 рівноважний ступінь перетворення Xp = 0, 9992. Тоді практичний ступінь перетворення за Н2О:
X = 0.96 · 0.9992 = 0.9592
Молярні маси учасників реакції:
M Н2О = 18, M С2Н5ОН = 46, M С2Н4 = 28.
Значення питомої ваги (густини) газів при нормальних умовах можуть бути легко визначені за формулою r = Мі/22, 4 [кг/м3].
r Н2О = 0.8036 кг/м3,
r С2Н5ОН = 2.0536 кг/м3,
r С2Н4 = 1.25 кг/м3.
Тоді за формулами (1.2 - 1.4), (1.6) отримаємо:
G Н2О = 1000 · 18/(46 ·0.9692) = 407.95 кг
V Н2О = 407.95/0.8036 = 507.65 м3
V = 507.65/0.448 = 1133.15 м3
V С2Н4 = 1133.15 · 0.552 = 625.5 м3
G С2Н4 = 625.5 · 1.25 = 781.88 м3
Результати обчислень заносимо до табл.1.1, стаття " Прихід". Після реакції залишається у суміші:
Gк Н2О = 407.95 · (1 – 0.9592) = 16.64 кг
Vк Н2О = 507.65 · (1 - 0.9592) = 20.71 м3
Gк С2Н4 = 781.88 – ((407.95 · 0.9592 · 28)/18) = 173.18 кг
Vк С2Н4 = 625, 5 – 507, 65 · 0, 9592 = 138, 56 м3
Результати обчислень заносимо до табл.1.1, стаття ”Витрати”.
Таблиця 1.1 - Матеріальний баланс
| Прихід | Витрати | |||||||
| Компонент | кг | % | м3 | %мол | кг | % | м3 | %мол |
| С2Н4 | 781, 88 | 65, 71 | 625, 5 | 55, 2 | 173, 18 | 14, 55 | 138, 56 | 21, 45 |
| Н2О | 407, 95 | 34, 29 | 507, 65 | 44, 8 | 16, 64 | 1, 4 | 20, 71 | 3, 20 |
| С2Н5ОН | - | - | - | - | 84, 05 | 486, 95 | 75, 35 | |
| Разом | 1189, 83 | 1133, 15 | 1189, 82 | 646, 22 |