
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изохорный процесс
|
|
Изохорным называется процесс, проходящий при постоянном объеме. Кривая процесса называется изохорой (рис. 4.1, 4.2).
1. Уравнение процесса v =const или dv =0.
2. Соотношение параметров. Для процесса 1-2 запишем уравнение состояния газа в точках 1 и 2

Разделив первое уравнение на второе, получим известный закон Шарля

т.е. при изохорном процессе изменение абсолютных давлений прямо пропорционально изменению абсолютных температур.

Рис. 4.1 Рис. 4.2
3. Изменение внутренней энергии. Для процесса 1-2 запишем уравнение первого закона термодинамики

Так как dv =0, то 
Интегрируя последнее уравнение, получим
 (4.4)
(4.4)
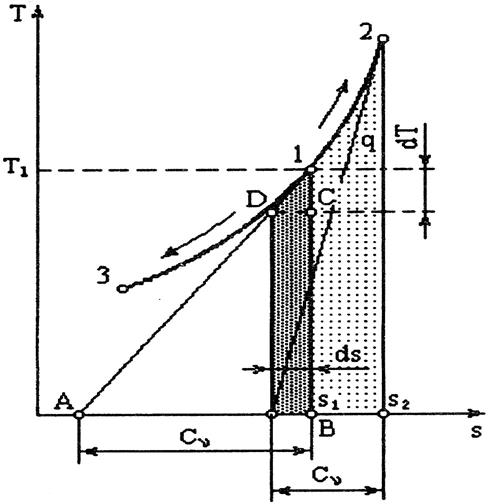
Рис. 4.3
Если T 2> T 1, то теплота qv в процессе 1-2 имеет положительный знак, т.е. она подводится. Если T 2< T 1, то теплота отрицательна, и она в процессе отводится. Количество подведенной (или отведенной) удельной теплоты qv графически определяется площадью под кривой процесса 1-2. Из рис. 4.3 видно, что произведение  равно площади элементарного прямоугольника. Если просуммировать все элементарные площади, то получим количество теплоты qv подведенное в изохорном процессе 1-2 или отведенное в процессе 1-3.
равно площади элементарного прямоугольника. Если просуммировать все элементарные площади, то получим количество теплоты qv подведенное в изохорном процессе 1-2 или отведенное в процессе 1-3.
4.Работа изменения объема газа. Ввиду того, что dv =0 работа dl=pdv= 0. То есть работа в изохорном процессе равна нулю, и
вся теплота, подводимая (отводимая) к рабочему телу, идет на изменение внутренней энергии. Удельная располагаемая работа l 0 определяется по формуле

5. Удельное количество теплоты определяется по формуле (4.4).
6. Изменение удельной энтропии найдем из уравнений первого и второго законов термодинамики. Запишем уравнение первого начала в виде

Разделив обе части этого уравнения на Т, получим
 (4.5)
(4.5)
Из уравнения состояния идеального газа pv = RT следует, что
 (4.6)
(4.6)
Подставляя (4.6) в (4.5), найдем 
Так как  , то
, то 
Интегрируя последнее соотношение, будем иметь
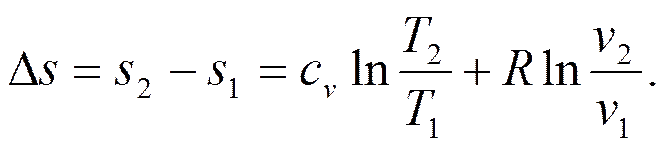 (4.7)
(4.7)
Так как в изохорном процессе v 1= v 2, то  Тогда
Тогда

Изображение термодинамического процесса в Ts координатах имеет ряд удобств. Как уже указывалось выше, площадью под кривой процесса определяется количество теплоты. Кроме того, используя кривую изохорного процесса в Ts координатах, можно определить значение истинной теплоемкости cv. Докажем данное утверждение. Если к точке 1 изохорного процесса (рис. 4.3) провести касательную 1-A, то подкасательная А-В в определенном масштабе представляет собой истинную теплоемкость cv этого процесса. В самом деле, из подобия треугольников D-1-C и А-1-В можно записать

Учитывая, что 1B=T; 1C= dT; DC= ds, получим AB dT = Tds = dq. Так как dq = cv dT, то AB dT = cv dT. Отсюда cv =AB, что и требовалось доказать.
Изохоры при различных объемах являются эквидистантными кривыми, имеющими при одной и той же температуре одинаковые угловые коэффициенты.