
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Атомно-кристаллнческое строение металлов
|
|
Металлы и сплавы в твердом состоянии - кристаллические тела. Атомы в них расположены закономерно в узлах кристаллической решетки и колеблются с частотой порядка 1013 Гц. Связь в металлах и сплавах электростатическая, обусловленная силами притяжения и отталкивания между положительно заряженными ионами (атомами) в узлах кристаллической решетки и коллективизированными электронами проводимости, плотность которых составляет 1022-1023 электронов в 1 см3, что в десятки тысяч раз превышает содержание атомов и молекул в воздухе. От специфических свойств электронов проводимости зависят электромагнитные, оптические, тепловые и другие свойства метатлов. Атомы в решетке стремятся занять положение, соответствующее минимуму ее энергии, образуя плотнейшие упаковки - кубическую объемно- и гранецентрированную и гексагональную (рис. 7.2).
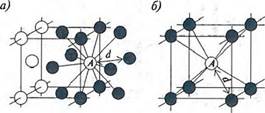 Рис. 7.2. Координационные числа (плотность упаковки) кристаллических решеток: а) кубической гранецентрированной (К 12); б) объемноцентрированной (К8); в) гексагональной (К 12)
Рис. 7.2. Координационные числа (плотность упаковки) кристаллических решеток: а) кубической гранецентрированной (К 12); б) объемноцентрированной (К8); в) гексагональной (К 12)
|
Плотность упаковки характеризуется координационным числом, представляющим собой число соседних атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем больше число, тем плотнее упаковка. Для объемноцентрированной кубической упаковки оно равно 8 (К8); гранецентрированной - 12 (К 12); гексагональной - тоже 12 (К12). В кубической объемноцентрированной решетке кристаллизуются К, Na, Li, a-Fe, Mo, W, V, Cr, Ba и др.; кубической гранецентрированной - Ni, Ag, Au, Pt, Cu, ^-Fe; в гексагональной - Mg, Cd, Ru, Be, a-Ti, a-Zn и др.
Расстояние между центрами ближайших атомов в решетке называется периодом решетки. Период решетки для большинства металлов находится в пределах 0, 1-0, 7 нм. Многие металлы в зависимости от температуры претерпевают структурные изменения кристаллический решетки. Так железо при температуре ниже 910°С и выше 1392°С имеет объемно - центрированную упаковку атомов с периодом решетки 0, 286 нм и обозначается a-Fe; в промежутке указанных температур кристаллическая решетка железа перестраивается в гранецентрированную с периодом 0, 364 нм, и обозначается y-Fe.
Перекристаллизация сопровождается выделением тепла при охлаждении и поглощением при нагревании, фиксируемым на диаграммах по горизонтальным участкам (рис. 7.3).
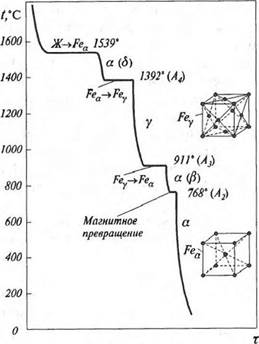 Рис. 7.3. Кривая охлаждения (нагревания)железа
Рис. 7.3. Кривая охлаждения (нагревания)железа
|
Металлы представляют собой поликристаллические тела, состоящие из большого числа мелких кристаллов неправильной формы. В отличие от кристаллов правильной формы их называют кристаллитами или зернами. Кристаллиты различно ориентированы, поэтому во всех направлениях свойства металлов более или менее одинаковы, т.е. поликристаллические тела изотропны, Однако при одинаковой ориентации кристаллитов такой мнимой изотропности наблюдаться не будет. Кристаллическая решетка металлов и сплавов далека от идеального строения. В ней имеются дефекты - вакансии и дислокации (см.гл.1, § 5).
§ 3. Основы получения чугуна и стали
Чугун получают в ходе доменного процесса, основанного на восстановлении железа из его природных оксидов, содержащихся в железных рудах, коксом при высокой температуре. Кокс, сгорая, образует углекислый газ. При прохождении через раскаленный кокс он превращается в оксид углерода, который и восстанавливает железо в верхней части печи по обобщенной схеме: Fe203-> Fe304—► FeO-^Fe. Опускаясь в нижнюю горячую часть печи, железо плавится в соприкосновении с коксом и частично растворяя его, превращается в чугун. В готовом чугуне содержится около 93% железа, до 5% углерода и небольшое количество примесей кремния, марганца, фосфора, серы и некоторых других элементов, перешедших в чугун из пустой породы. В зависимости от количества и формы связи углерода и примесей с железом, чугуны имеют разные свойства, в том числе цвет, подразделяясь по этому признаку на белые и серые.
Сталь получают из чугуна путем удаления из него части углерода и примесей. Существуют три основных способа производства стали: конвертерный, мартеновский и электроплавильный.
Конвертерный основан на продувке расплавленного чугуна в больших грушевидных сосудах-конвертерах сжатым воздухом. Кислород воздуха окисляет примеси, переводя их в шлак; углерод выгорает. При малом содержании в чугуне фосфора конвертеры футеруют кислыми огнеупорами, например динасом, при повышенном - основными, периклазовыми. Соответственно выплавляемую в них сталь по традиции называют бессемеровской и томасовской. Конвертерный способ отличается высокой производительностью, обусловившей его широкое распространение. К недостаткам его относятся повышенный угар металла, загрязнение шлаком и наличие пузырьков воздуха, ухудшающими качество стали. Применение вместо воздуха кислородного дутья в сочетании с углекислым газом и водяным паром значительно улучшает качество конвертерной стали.
Мартеновский способ осуществляется в специальных печах, в которых чугун сплавляется вместе с железной рудой и металлоломом (скрапом). Выгорание примесей происходит за счет кислорода воздуха, поступающего в печь вместе с горючими газами и железной рудой в составе оксидов. Состав стали хорошо поддается регулированию, что позволяет получать в мартеновских печах высококачественные стали для ответственных конструкций.
Электроплавление является наиболее совершенным способом получения высококачественных сталей с заданными свойствами, но требует повышенного расхода электроэнергии. По способу ее подведения электропечи подразделяются на дуговые и индукционные. Наибольшее применение в металлургии имеют дуговые печи. В электропечах выплавляют специальные виды сталей - средне- и высоколегированные, инструментальные, жаропрочные, магнитные и другие.