
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Роль углеводородов в тропосферных фотохимических процессах
|
|
В атмосферу поступают разнообразные по строению и молекулярной массе углеводороды. Прежде всего это СН4, выделяющийся в естественных процессах (микробиологическая активность в почвах, _______________________________________________) и антропогенного происхождения (те же______________). С продуктами сгорания топлив в ДВС, стационарных установках в атмосферу выбрасывается большой набор разных по строению веществ – алканы, алкены, ароматические углеводороды.
У/в в атмосфере окисляются активными компонентами – атомарным О, О3 и гидроксильным радикалом, который играет исключительно важную роль в химических превращениях загрязняющих веществ в тропосфере.
Окисление у/в протекает по радикальному (_____________) механизму через образование на одной из стадий пероксидного радикала 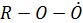 способного окислять NO:
способного окислять NO:
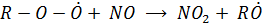 (алкоксильный радикал)
(алкоксильный радикал)
Эта реакция ускоряет образование NO2 и включение его в фотолитический цикл. При этом скорость данной реакции значительно больше, чем скорость реакции, в которой расходуется окислитель озон (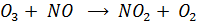 )
)
Это и приводит к накоплению озона.
Окислители у/в – атомарный О и О3 образуются в рассмотренном фотолитическом цикле NO2. Атомарный О в основном участвует в образовании озона, но частично может расходоваться на реакции с у/в
Гидроксильныйрадикал образуется:
1) главным образом по реакции с Н2О атомарного О(1Д), выделяющегося при фотолизе озона (в основном эта реакция идет в верхних слоях тропосферы, куда проникает излучение с λ < 300 нм)
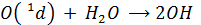
2) дополнительное количество ОН радикала в тропосфере дает реакция О3 с НО2, который образуется по нескольким реакциям (о них ниже)

3) и кроме того ОН радикалы, хотя и начинают процесс окисления у/в, т.е. в начале расходуются, но в этих же процессах и накапливаются в условиях загрязненной антропогенными выбросами атмосферы
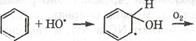
ОН-радикал наиболее важный оислитель в тропосфере, он начинает большинство многостадийных процессов окисления у/в и других примесей.
Рассмотрим некоторые из них с деталями механизма
Окислении метана и его гомологов
Окисление метана инициируется ОН-радикалом. В последующем в процесс включается молекулярный О2. Сопряжено с окислением СН4 идет окисление NO (т.е. NO включается в цепочку реакций на одной из стадий)
Начальная стадия 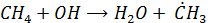
Взаимодействие алкильного (метильного) радикала с О2 дает пероксильный радикал:
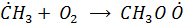 , который как отмечалось определяет альтернативный механизм окисления NO в NO2 (вместо окислителя О3)
, который как отмечалось определяет альтернативный механизм окисления NO в NO2 (вместо окислителя О3)
Т.е. 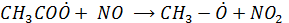
(алкоксильный (метоксильный))
Взаимодействие радикала 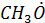 с О2 приводит к образованию формальдегида и гидропероксидного радикала
с О2 приводит к образованию формальдегида и гидропероксидного радикала
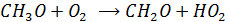
Образующийся NO2 включается в фотолитический цикл
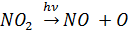
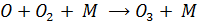
Что приводит к образованию озона
Гидропероксидный радикал окисляет NO (как и 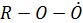 )
)
 , генерируя ОН радикал
, генерируя ОН радикал
Таким образом процесс окисления СН4 (и углеводородов вообще) – совокупность реакций, инициируемых солнечным излучение с λ =300-400 нм (которые приводят к О, ОН, НО2), протекающий при участии NO и приводящий к накоплению окислителей О3, ОН
Окисление у/в в этом процесс сопровождается также вторичным загрязнением атмосферы оксидом углерода, которые образуется при превращении СН2О (что по масштабности сопоставимо с выбросами СО при сжигании топлива)
Фотодиссоциация -  (
(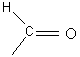 формильный
формильный
карбонильный радикал)
(либо взаимодействие с OH 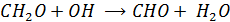 )
)
Окисление 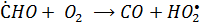
НО2 также дает другая реакции 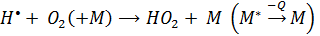
Формальную схему суммарной реакции окисления СН4 можно записать в виде
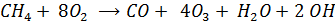
Таким образом в воздухе накапливается озон и гидроксорадикал, Причем скорость образования О3 зависит от содержания в атмосфере NO – она тем больше чем выше концентрация NO
Озон в тропосфере уже выполняет не защитную функцию как в стратосфере, а губительную вследствие сильных губительных свойств.
По подобной схеме окисляются и другие у/в алканового ряда. При этом скорость взаимодействия у/в с ОН радикалом сильно зависит от строения молекулы алкана (от стабильности образующегося у/в радикала) Очевидно скорость (как стабильность R•) возрастает с увеличением длины цепи и разветвленности алкана, Поэтому например скорость взаимодействия бутана с ОН радикалом на 3 порядка выше, чем с СН4 (к скорости соответственно 2, 6·10-12 и 8·10-15).
При окислительных превращениях гомологов метана возможен еще один очень важный путь развития процесса, связанный с реакцией карбонильного радикала с О2
В случае с метаном простейший карбонильный радикал -  , образовавшийся из формальдегида, приводит к СО (по рассматриваемым реакциям)
, образовавшийся из формальдегида, приводит к СО (по рассматриваемым реакциям)
В случае с другими углеводородами карбонильный радикал (со структурой, определяемой структурой исходного углеводорода) присоединяет О2

Давая ацилпероксидный радикал, который в конечном итоге приводит к образованию важнейших (с точки зрения воздействия на ОС) продуктов веществ группы ПАН – пероксиацилнитратов.
ПАН- вещества общей формулы 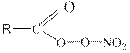 (R – углеводородный радикал) являются наиболее опасными компонентами фотохимического смога. Из них наиболее известен пероксиацетил нитрат, т.е.
(R – углеводородный радикал) являются наиболее опасными компонентами фотохимического смога. Из них наиболее известен пероксиацетил нитрат, т.е. 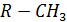
Таким образом фотохимические и окислительные превращения углеводородов с участие NОx являются главной причиной образования фотохимического смога – смеси газообразных веществ в сильными окислительными свойствами.
Образование фотохимического смога – обычное явление для крупных городов в большим количество автотранспорта. Выхлопные газы ДВС содержат в сове составе NОx и у/в, которые распространяются в фактически в зоне дыхания.
Обобщим все что говорилось об окислении у/в в единую схему, которой принято описывать образование фотохимического смога
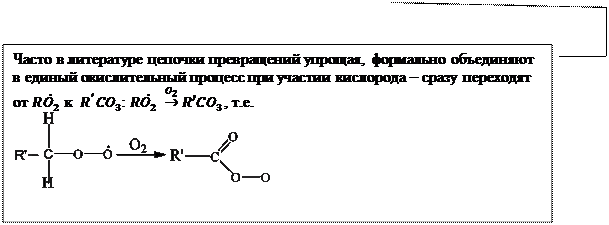

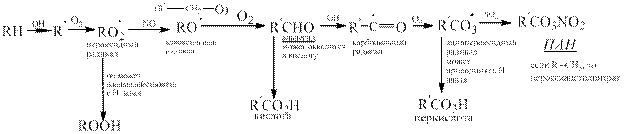
|
|
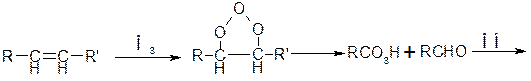
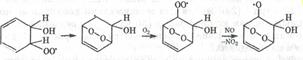 Значительную долю у/в в атмосфере составляют ароматические у/в (в городах 30-40% от всех органических соединений). Они окисляются гидроскорадикалом по различны механизмам. Основным направление окисление является раскрытие цикла
Значительную долю у/в в атмосфере составляют ароматические у/в (в городах 30-40% от всех органических соединений). Они окисляются гидроскорадикалом по различны механизмам. Основным направление окисление является раскрытие цикла
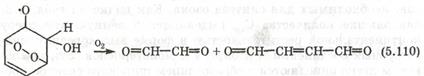
C образованием перокидного радикала, который окисляется О2 с участием NO через ряд промежуточных стадий, включающих внутримолекулярную циклизацию пероксидного радикала) с раскрытием цикла с образованием дикарбонильных соединений.
Гомологи бензола дают большое число различных продуктов. Например при окислении толуола зарегистрировано более 40 (47) соединений, половина из которых диальдегиды и альдегиды дикарбонильных соединений легко фотохимически разлагаются с образованием различных радикалов.
Таким образом фотохимический смог – смесь разнообразных продуктов фотохимических и окислительных реакций озона, альдегидов, кислот, пероксидных соединений, свободных радикалов, ПАН, главным из которых является окислители – озон и вещества группы ПАН. ПАН отличаются высокой токсичностью для человека, а также подавляют процесс фотосинтеза. Кроме того компоненты фотохимического смога будучи сильными окислителями, оказывают разрушительное действие на конструкционные материалы – усиливают коррозию металлических конструкций, разрушение строительных соединений.
Вредное воздействие смога на живые организмы обусловлено также присутствием альдегидов – весьма токсичных веществ.
Интересно проследить за изменением концентрации основных компонентов, участвующих в образовании фотохимического смога (например для города с активными физико-химическими условиями) в течение суток

Как видно из графиков – содержание NO достигает максимум быстрее по мере увеличения интенсивности движения транспорта, чем содержание NO2 (со смещением в несколько часов).
Концентрация окислителей достигает максимума только после нескольких часов воздействия солнечного света.
Образование фотохимического смога – один процессов в котором участвуют гидроксильные радикалы, окисляя у/в.
Другие реакции с участием гироксильного радикала
Гидроксильный радикал участвует в атмосфере также в реакциях с NOx, CO, O3 и соединений серы
1. Оксиды азота при взаимодействии с ОН дают соответствующие кислоты
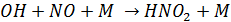
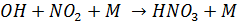
(М как и в случае образования озона – третий компонент, необходимый для поглощения избытка энергии)
2. CO окисляется гидроксильным радикалом до CO2
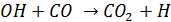 - очень важная реакция, составляющая единственный абиотический сток СО из атмсоферы
- очень важная реакция, составляющая единственный абиотический сток СО из атмсоферы
Образующийся атом Н очень быстро реагирует с О2, давая HO2
 (M – та же функция)
(M – та же функция)
3. Озон также генерирует НО2 при реакции с ОН
___________________________________
НО2 наряду с ОН играет важную роль в химии атмосферы, будучи сильным окислителем.
В частности, он эффективно воспроизводит гидроксильный радикал, окисляя NO
|
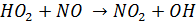
При этом также образуется NO2, включающийся в фотохимический цикл и ускоряющий процесс образования озона
4. Под действием ОН радикала происходит также окисление до SO2 (CH3)2S – основное органическое соединение серы, которое как отмечалось выделяется в атмосферу в результате жизнедеятельности почвенных микроорганизмов, а также и высших растений
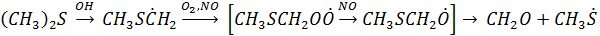
Дальнейшие превращения радикала CH3S приводит к образованию метансульфоной кислоты CH3SO2OН и SO2 метансульфоновая кислота окисляется до H2SO4
Фотохимическое окисление S-содержащих органических веществ играет главную роль в образовании SO2 в районах, не подвергающихся загрязнению этим веществом.