
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Серы и азота кислотные дожди
|
|
Соединения серы
К распространенным соединениям серы, присутствующим в атмосфере относятся SO2, COS, CS2, H2S, (CH3)2S, SO42- в аэрозолях сульфатов. Наибольшая концентрация из них характерна для SO2 – в городских районах она может составлять 50 – 4000 мкг/м3. Средняя концентрация серосодержащих веществ в атмосфере районов, примыкающих к промышленным центрам характеризуют следующие цифры (мкг/м3)
| SO2 | 10-50 | COS | 0, 6-0, 8 |
| CS2 | 0, 5-0, 6 | (CH3)2S | 0, 01-0, 1 |
| H2S | 0, 05-0, 2 | SO42- | 1-10 |
Соединения серы попадают в атмосферу естественным путем и от антропогенных источников.
Естественная эмиссия сернистых соединений обусловлена тремя факторами:
1) Деятельность почвенных и водных (главным образом морских) микроорганизмов. Это в основном анаэробные процессы разложения органических веществ, в результате которых органическая сера переходит в газообразное состояние (восстановительные формы – H2S, меркаптарны RSH, диметилсульфид – главным образом выделяется при разложении морских водорослей, с городах микробиологическое разложение на свалках бытовых отходов). Основной вклад в данном случае вносят болота, устья рек, зоны приливов и отливов, этим путем в атмосферу вносится примерно 1/3 соединений серы.
2) Вулканическая деятельность - с извержением вулканов в атмосферу попадает примерно в 10 раз меньше соединений серы, чем при биологическом выделении. Главным образом это SO2, H2S, SO42-.
3) Поверхность океанов - с поверхности морской воды в атмосферу уностся брызги, при испарении которых остаются соли, в т.ч. сульфаты. С частицами соли в атмосферу поступает примерно в 4-5 раз больше серы, чем в результате биологических процессов. Но в тоже время частицы соли из-за крупных размеров быстро осаждаются и лишь очень малая их часть попадает в более высокие слои атмосферы и рассеивается в воздухе над сушей.
Результатом антропогенной деятельности является выброс в атмосферу главным образом SO2
Основные техногенные источники SO2
1. процессы сжигания органических топлив на ТЭС, в технологических агрегатах (печах) – прежде всего угля, а также нефтяных жидких топлив (и газообразных). В углях различных бассейнов содержание серы колеблется в достаточно широких пределах – например, в углях Кузбасса (на данный момент основного поставщика углей) содержание серы 0, 8-1%, в углях Ростовского бассейна – до 2, 5%, Кизеловского – до 4%.
Нефтяные топлива – мазуты, печные топлива могут содержать S до 2, 5%. Однако объемы нефтяных топлив энергетического использования значительно меньше, чем угля, поэтому их вклад в общий выброс серы ниже.
Ежегодная добыча угля в мире оценивается 3, 2 млрд. тон, из которых напрямую сжигается – 80%, из добываемых ежегодно 4, 2 млрд т. Нефти производят 30% топлив энергетического и технологического использования, и основным продуктом является моторные топлива. Однако в моторных топливах содержание серы составляет < 0.1% в бензине и < 0.5% в ДТ, поэтому транспорт в общие выбросы SO2 вносит очень незначительный вклад (~1%), хотя в городах с интенсивным движение его роль может быть высока.
2. Процессы в цветной металлургии прежде всего обжиг сульфидных руд (основного вида сырья) при получении Cu, Zn, Pb и т.п.
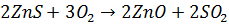
Образующийся SO2 присутствует в отходящих газах в количестве до 5%. Он естественно, улавливается и перерабатывается в H2SO4. Но полное извлечение SO2 из обжиговых газов невозможно (нерентабельно) поэтому часть его с хвостовыми газами выбрасывается в атмосферу.
3. Предприятия по производству серной кислоты – здесь также в атмосферу выбрасываются не полностью очищенные хвостовые газы, содержащие SO2
4. К источникам выбросов SO2 относятся также нефтеперерабатывающие заводы и коксохимические заводы (газоперерабатывающие заводы) но на этих предприятиях причиной выбросов являются те же процессы сжигания топлива или производства серной кислоты (либо серы), которые есть в составе этих предприятий (правда в этом случае сырье иное – H2S – компонент заводских газов либо природного – есть уникальное месторождение природного газа, где в составе природного газа 20-30% H2S).
Диоксид серы наиболее вредный газ из числа загрязнителей атмосферы. Время его пребывания (жизни)в атмосфере в среднем исчисляется несколькими сутками (все определяется конкретными условиями). Это время слишком мало для распространения в глобальном масштабе. Поэтому проблема SO2 характерна в первую очередь для промышленно развитых стран и их ближайших соседей.
SO2 оказывает прямое токсическое действие на живые организмы (теплокровных животных, людей, растительность) и кроме того его химические превращения в атмосфере в присутсвии влаги приводят а выпадению кислотных дождей, что представляет опасность как для биоты, так и для техногенной составляющей биосферы.
Воздействие SO2 на живые организмы
Физиологическое воздействие SO2 на людей и животных связано с образованием сернистой кислоты на влажной слизистой оболочке бронхов. Результатом является раздражение слизистой оболочки, вызывающее сильный кашель. Эти симптомы наблюдаются при концентрации ~ 10 мг/м3 (ПДК мр =0, 5 мг/м3). Примерно 10% людей страдают повышенной чувствительностью к SO2, у них опасные симптомы (вплоть до спазмов дыхательных путей) возникают при концентрации ~1 мг/м3.
Часто вред организму, наносимый SO2 усугубляется действием других факторов – в частности при совместном присутствии пыли и SO2 возникает опасность заболевания хроническим бронхитом- это объясняется сорбцией SO2 на мельчайших твердых частицах, которые могут проникать в альвеолы легких не задерживаясь на слизистой оболочке.
Усиление вредного действия SО2 наблюдается и при совместном присутствии в воздухе SO2 и NO2, (NO2 окисляет SO2 в SO3)
На растения SO2 действует двояко: непосредственно на листья или косвенно в виде кислотных осадков через почву. Прямое действие тесно связано с образованием H2SO3 цитоплазме клетки. Причем растения значительно чувствительнее реагируют на HSO3- чем на HSO4-. Под влиянием SO2 желтеют литья растений – причиной этого является вымывание иона Mg2+ из порфиринового кольца хлорофилла при подкислении цитоплазмы. Иначе говоря, SO2 разрушает хлорофилл и соответственно оказывает тормозящее действие на фотосинтез.
Токсичное действие SO2 на растительность сильнее проявляется в темноте чем на свету, поскольку на свету бисульфат-ион HSO3- способен восстанавливаться в хлоропластах листьев до органически связанной группой HS-, которые являются исходными компонентами в синтезе серосодержащих аминокислот цистеина и метионина.
Химические превращения SO2 в атмосфере
Важнейшие из химических превращений – окисление и образование серной кислоты.
Можно выделить три типа атмосферных процессов окисления SO2:
- гомогенное газофазное
- гетерогенное на поверхности твердых частиц аэрозолей
- окисление в жидкой фазе (точнее в жидко-капельной) фазе
В зависимости от конкретных условий атмосферы вклад того или иного процесса в суммарной может существенно меняться.
Газофазное окисление
В гомогенном газофазном окислении SO2 участвуют основные окислительные агенты атмосферы О2, О3, радикал НО, НО2, RO2. Первая стадия реакций окисления SO2 этими агентами выглядит (окислительные процессы сложны по механизму, многостадийны, поэтому все не рассматриваем, важна 1-я стадия):
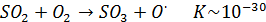


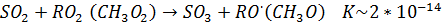
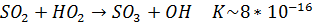
Видно, что основной по массе окислитель атмосферы – молекулярный кислород не оказывает существенного влияния на судьбу SO2, как впрочем и озон. Основной окислитель наиболее быстро реагирующий с SO2 в газовой фазе – радикалы. Они, как ранее отмечалось, генерируются в атмосфере при наличии солнечного излучения (при окислении углеводородов) таким образом можно сделать вывод что газофазное окисление происходит практически полностью в дневное время. Также можно отметить, что в сильно загрязненной углеводородами атмосфере окисление SO2 ускоряется (именно окисление углеводородов приводит в образованию активных НО2, ОН, RO2)
Гетерогенное окисление
Молекулы SO2 активно сорбируются на поверхности атмосферного аэрозоля. Особенно высока сорбционная емкость по отношению к SO2 летучей золы и сажи. Образование при сжигании угля и нефтяных топлив окислителями SO2 являются радикалы, как полагают генерирование воздействием солнечного излучения на поверхности твердых частиц. Из адсорбированных на той же поверхности молекул О2 или Н2О2 или радикалы, образование при фотодиссоциации воды (H2O→ OH+H)
Окисление в жидкокапельной фазе облаков и туманов катализируются аквакомплексами ионов переходных металлов Их разложение под действием света приводит к появлению радикалов, например:

И далее растворенный SO2 взаимодействует с гидроксилом


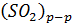 – по сути ион
– по сути ион 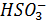 который легко окисляется
который легко окисляется
Кроме того в водной фазе SO2 взаимодействует с растворенным Н2О2 и озоном:
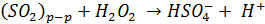
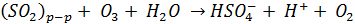
Как уже отмечалось на жидкофазный процесс окисления значительное влияние оказывает рН капель атмосферной влаги, поскольку определяют растворимость SO2 и соотношение молекулярной и ионной форм (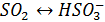 )/
)/
Соотношение скоростей окисления по газофазному, гетерогенному и жидкофазному механизмам составляет примерно 2: 1, 5: 1
Суммарная скорость окисления определяется вкладом всех трех процессов, который может существенно меняться.
Образовавшийся при окислении SO2 триоксид с большой скоростью превращается в серную кислоту

Эти процессы превращения SO2 в  во влажных условиях в зимний отопительный сезон получил известность в начале 20 века, когда в результате дымовых выбросов, содержащих SO2, В Лондоне отмечалось возникновение густого тумана, в котором происходило медленное образование аэрозоля H2SO4 – он был назван впоследствии смогом классического лондонского типа [сажа+SO2+аэрозоль H2SO4] (в отличие от фотохимического - Лос-Анжелеского).
во влажных условиях в зимний отопительный сезон получил известность в начале 20 века, когда в результате дымовых выбросов, содержащих SO2, В Лондоне отмечалось возникновение густого тумана, в котором происходило медленное образование аэрозоля H2SO4 – он был назван впоследствии смогом классического лондонского типа [сажа+SO2+аэрозоль H2SO4] (в отличие от фотохимического - Лос-Анжелеского).
Образование H2SO4 в атмосфере приводит к выпадению кислотных дождей.
Серная кислота в атмосфере может нейтрализоваться присутствующими в атмосфере аммиаком либо щелочными солями с образованием сульфатов – главным образом солей аммония. В результате протекания процессов нейтрализации время жизни H2SO4 в среднем составляет около 2 суток (50 часов). Таким образом при атмосферном переносе SO2 состав химических загрязнителей, содержащих серу меняется по мере удаления от источника. Соотношение между концентрациями SO2, H2SO4 и конечными продуктами – сульфатами в ходе атмосферного переноса отражает график:

Максимальное количество серы в составе H2SO4 достигает при пятикратном уменьшении количества SO2. Примерно через 30 часов переноса (при скорости ветра 30 км/ч, что соответствует расстоянию 900 км) уже начинают преобладать сульфаты.