
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Типы гидролиза. 1. Соли, образованные сильным основанием и сильной кислотой.
|
|
1. Соли, образованные сильным основанием и сильной кислотой.
Например:
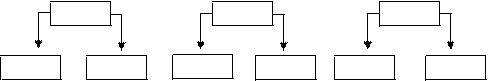
Na2SO4 KCl LiNO3
и т. д.
NaOH H2SO4 KOH HCl LiOH HNO3
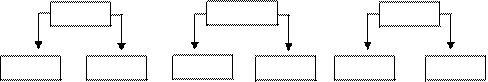
2. Соли, образованные сильным основанием и слабой кислотой.
Например:
Na2CO3 K2S
и т.д.
NaOH H2CO3 KOH H2S
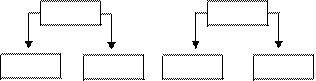
3. Соли, образованные слабым основанием и сильной кислотой.
Например:
CuSO4 Zn(NO3)2 FeCl3
и т. д.
Cu(OH)2 H2SO4 Zn(OH)2 HNO3 Fe(OH)3 HCl
4. Соли, образованные слабым основанием и слабой кислотой.
Например:
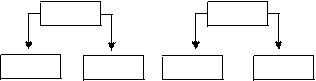
ZnS Cu(CN)2
и т.д.
Zn(OH)2 H2S Cu(OH)2 HCN
Гидролиз - процесс чаще всего обратимый. Обратимые реакции обозначают < ==>.
Обратимые реакции - это реакции, идущие как в сторону прямой, так и обратной реакции.
Прямая реакция - реакция, в результате которой образуются продукты реакции.
Обратная реакция - реакция, в результате которой образуются вновь исходные вещества.
прямая реакция
CuCl2 + H2O < ==============> CuOHCl + HCl
обратная реакция
исходные продукты
вещества реакции
1. Соли, образованные сильным основанием и сильной кислотой гидролизу не подвергаются.
Например: Na2SO4 + H2O < =/=> гидролизу не подвергается.
2. Соли, образованные сильным основанием и слабой кислотой, при гидролизе образуют сильное основание и кислую соль (Исключение составляют соли, образованные сильным основанием и одноосновной кислотой). Гидролиз по аниону, среда щелочная.
Например:
Na2CO3 + H2O < ==> NaOH + NaHCO3
 / \ СO32- + H+OH < ==> HCO3- + OH- (краткое
/ \ СO32- + H+OH < ==> HCO3- + OH- (краткое
NaOH H2CO3 ионное уравнение)
cильн. слабая
основан. кислота
гидролиз по аниону (СO32-)
среда щелочная (OH-) рН > 7
3. Соли, образованные слабым основанием и сильной кислотой, при гидролизе образуют сильную кислоту и основную соль (Исключение составляют соли, образованные одновалентными металлами). Гидролиз по катиону, среда кислая.
Например:
CuCl2 + H2O < ==> HCl + CuOHCl
 / \ Сu2+ + H+OH < ==> CuOH+ + H+ (краткое
/ \ Сu2+ + H+OH < ==> CuOH+ + H+ (краткое
Cu(OH)2 HCl ионное уравнение)
cлабое сильная
основан. кислота
гидролиз по катиону (Сu2+)
среда кислая (H+) рН < 7
4. Соли, образованные слабым основанием и слабой кислотой, при гидролизе образуют слабое основание и слабую кислоту. Гидролиз по катиону и аниону. Среда зависит от продуктов реакции.
Например:
Al2S3 + 6H2O < ==> 2Al(OH)3↓ + 3H2S
 / \ 2Al3+ + 3S2- + 6H+OH- < ==> 2Al(OH)3↓ + 3H2S
/ \ 2Al3+ + 3S2- + 6H+OH- < ==> 2Al(OH)3↓ + 3H2S
Al(OH)3 H2S (полное и краткое ионные уравнения совпадают)
слабое слабая гидролиз по катиону и аниону.
основан. кислота среда нейтральная рН = 7