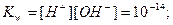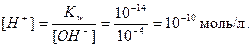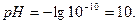Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ионное произведение воды. Водородный показатель
|
|
ЛЕКЦИЯ
Вода является слабым электролитом. Уравнение диссо-циации воды записывают следующим образом:
H2O < ==> H+ + OH-.
Константа диссоциации воды:
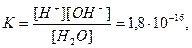 при 298 К.
при 298 К.
· Произведение 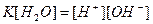 называют ионным произведением воды и обозначают
называют ионным произведением воды и обозначают 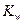
Вода - очень слабый электролит, пренебрегая продиссоциировавшей частью молекул, можно принять равновесную концентрацию недиссоциированных молекул 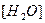 равной общему количеству вещества воды в одном литре, т.е.
равной общему количеству вещества воды в одном литре, т.е.
 моль/ л.
моль/ л.
Тогда при 298 К (25 0С):
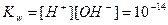 .
.
Ионное произведение воды при постоянной температуре постоянно не только для воды, но и для водных растворов. Зная концентрацию ионов H+, можно рассчитать концентрацию OH-, и наоборот. Понятия кислая, нейтральная и щелочная среда можно оценить количественно по концентрации ионов H+ или OH-.
Более удобно для характеристики среды пользоваться водородным показатем:
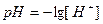 .
.
В нейтральной среде
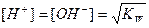 ,
,
при 25 0С 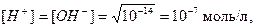
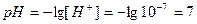 .
.
В кислой среде
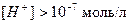 ,
, 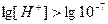 ,
, 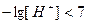 , т.е.
, т.е. 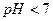 .
.
В щелочной среде
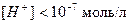 ,
, 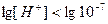 ,
, 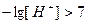 , т.е.
, т.е. 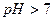 .
.
Систематизируем характеристики реакции среды в виде таблицы:
| Среда | [H+], моль/л | [OH-], моль/л | рН |
| нейтральная | 10-7 | 10-7 | |
| кислая | > 10-7 | < 10-7 | < 7 |
| щелочная | < 10-7 | > 10-7 | > 7 |
Определение pH с помощью специальных приборов, называемых pH-метрами, можно проводить в диапазоне от 0 до 14 с точностью до 0, 01 единицы pH. Для менее точной оценки рН используют так называемые кислотно-щелочные индикаторы, (фенолфталеин, лакмус и др.) и их смесь – универсальный индикатор.
· Задача 1. Вычислите рН 0, 01 М раствора соляной кислоты.
Решение. Водородный показатель 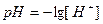 . Соляная кислота является сильным электролитом, т.е. в водном раст-воре полностью распадается на ионы: HCl = H+ + Cl-. Молярная концентрация ионов водорода в данном случае равна молярной концентрации кислоты:
. Соляная кислота является сильным электролитом, т.е. в водном раст-воре полностью распадается на ионы: HCl = H+ + Cl-. Молярная концентрация ионов водорода в данном случае равна молярной концентрации кислоты:
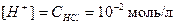 ;
; 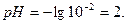
· Задача 2. Вычислите рН 0, 001М раствора NaOH.
Решение. NaOH - щелочь, сильный электролит, в водном растворе полностью распадается на ионы: NaOH = Na+ + OH-. Молярная концентрация гидроксид-ионов равна молярной концентрации NaOH:
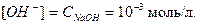
Концентрацию ионов водорода определяем по ионному произведению воды: