
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
от различных факторов
|
|
· Степень гидролиза (h) - отношение числа гидролизован-ных молекул к общему числу молекул соли в растворе. Значение h выражают в долях единицы или процентах.
Степень гидролиза зависит от природы соли, концентрации раствора и температуры. Влияние природы соли заключается в следующем: чем слабее основание и кислота, образующие соль, тем больше степень гидролиза соли. В таблице приведены значения величины h для 0, 1М растворов солей:
| Формула соли | h, % |
| NH4Cl Na2CO3 (NH4)2CO3 | 0, 01 2, 7 |
NH4Cl – соль слабого основания, 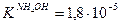 ; Na2CO3 – соль слабой кислоты,
; Na2CO3 – соль слабой кислоты, 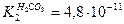 , т.е. NH4OH – более сильный электролит, и его соль в меньшей степени подвергается гидролизу. В наибольшей степени гидролизуется (NH4)2CO3 - соль слабого основания и слабой кислоты.
, т.е. NH4OH – более сильный электролит, и его соль в меньшей степени подвергается гидролизу. В наибольшей степени гидролизуется (NH4)2CO3 - соль слабого основания и слабой кислоты.
При разбавлении раствора (уменьшении концентрации) степень гидролиза увеличивается. Так степень гидролиза Na2CO3 в 0, 1М растворе составляет 2, 7%, а в 0, 01 М растворе – 34%.
Повышение температуры приводит к увеличению степени гидролиза, так как гидролиз - процесс эндотермический.
Знание закономерностей гидролиза необходимо при практическом использовании растворов солей. К примеру, при очистке природных и сточных вод от катионов металлов гидролиз стремятся усилить, сделать необратимым, чтобы продукты реакции можно было удалить в виде осадков. Напротив, гидролиз при синтезе неорганических веществ в водных растворах – неприятное осложнение. В получаемом веществе появляются примеси продуктов гидролиза. Например, при получении сульфата меди (II) в его кристаллы попадает примесь (CuOH)2SO4. Поэтому кристаллизацию сульфата меди производят из растворов, содержащих некоторое количество серной кислоты, добавленной с целью подавления гидролиза.