
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химические свойства алканов
|
|
Алканы достаточно инертны ко многим реагентам.
4.5.1. Полное окисление. Полное окисление при избытке кислорода протекает по схеме реакции горения:
 СnH2n + 2 + [ n +
СnH2n + 2 + [ n + 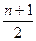 ] n CO2 + (n + 1)H2O. (4.1)
] n CO2 + (n + 1)H2O. (4.1)
4.5.2. Неполное окисление, согласно теории Н. Н. Семенова и Н. М. Эммануэля, протекает по радикально-цепному механизму и включает четыре стадии: зарождение цепи, продолжение цепи, разветвление цепи и обрыв цепи.
Зарождение цепи
 RH + O2 R + HO2
RH + O2 R + HO2  ; (4.2)
; (4.2)

 2RH + O2 2R
2RH + O2 2R  + H2O2. (4.3)
+ H2O2. (4.3)
Энергия разрыва связи С – Н в зависимости от природы соединения составляет от 290 до 420 кДж/моль.
Продолжение цепи
 R
R  + O2 RO2
+ O2 RO2  ; (4.4)
; (4.4)
 RO2
RO2  + RH ROOH + R
+ RH ROOH + R  . (4.5)
. (4.5)
гидропе-
роксид
Возможна и такая реакция, особенно при жидкофазном окислении, протекающая с разрывом связи С – С:
 RO2
RO2  R/CHO + R//O
R/CHO + R//O  . (4.6)
. (4.6)
Разветвление цепи
 ROOH RO
ROOH RO  + OH
+ OH  (4.7)
(4.7)
или
 ROOH + RH RO
ROOH + RH RO  + R
+ R  + Н2О; (4.8)
+ Н2О; (4.8)

 2RO
2RO  ROOR. (4.9)
ROOR. (4.9)
пероксид
Обрыв цепи при жидкофазном окислении. Гибель свободных радикалов может происходить при взаимодействии их со стенкой реактора. Вследствие высокой вязкости среды в жидкой фазе диффузия радикалов к стенке затруднена и в ней происходит в основном квадратичный обрыв цепи:
 R
R  + R
+ R  R – R; (4.10)
R – R; (4.10)
 R
R  + RO
+ RO  R – O – R; (4.11)
R – O – R; (4.11)
 R
R  + RO2
+ RO2  2ROH; (4.12)
2ROH; (4.12)
 2R
2R  + H2O2 2ROH и т. д. (4.13)
+ H2O2 2ROH и т. д. (4.13)
Эти реакции идут с небольшой энергией активации (4 – 8 кДж/моль).
Неполное окисление легких углеводородов. Известны в промышленности процессы окисления метана, этана, бутана. Окисление легких алканов ведут при низких (150 – 250 оС) и высоких (400 – 600 оС и выше) температурах с применением катализаторов и без них при различных временах контакта.
В зависимости от условий реакции протекают по-разному.
электрический
пиролиз
 2СН4 С2Н2 + 3Н2; (4.14)
2СН4 С2Н2 + 3Н2; (4.14)
 СН4 + 1/2О2 СО + 2Н2; (4.15)
СН4 + 1/2О2 СО + 2Н2; (4.15)
синтез-газ
Мn2+ или Cu2+
 СН4 + 1/2О2 СН3ОН + 130 кДж/моль; (4.16)
СН4 + 1/2О2 СН3ОН + 130 кДж/моль; (4.16)
метанол
катализатор
 СН3ОН + 1/2О2 НСНО + Н2О + 147 кДж/моль; (4.17)
СН3ОН + 1/2О2 НСНО + Н2О + 147 кДж/моль; (4.17)
формаль-
дегид
Pt(Pd)
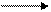 НСНО + 1/2О2 НСООН + 275 кДж/моль. (4.18)
НСНО + 1/2О2 НСООН + 275 кДж/моль. (4.18)
муравьиная
кислота
В промышленной практике окисление алканов ведут в газовой фазе при значительном избытке углеводородов без катализатора при температуре 330 – 370 оС. О влиянии соотношения углеводород: кислород на примере пропилена дает представление табл. 4.5.
Таблица 4.5
Химический состав продуктов окисления С3Н6 при 275оС
| Продукт | Объемное соотношение С 3 Н 6: воздух | ||||
| 1: 20 | 1: 15 | 1: 3, 6 | 1: 1, 25 | 1: 0, 15 | |
| Альдегиды | 12, 5 | 6, 6 | 12, 0 | 16, 1 | 16, 7 |
| Спирты | 17, 3 | 25, 7 | 23, 0 | 33, 1 | 34, 5 |
| Изопропанол | 2, 7 | 6, 9 | 5, 2 | 5, 2 | 14, 4 |
| Ацетон | 1, 2 | 1, 4 | 1, 3 | 7, 4 | |
| Кислоты | 13, 9 | 13, 4 | 15, 2 | 8, 9 | 12, 5 |
| Всего продуктов неполного окисления | 47, 3 | 56, 0 | 56, 7 | 63, 6 | 85, 5 |
| Диоксид углерода | 31, 5 | 25, 0 | 22, 1 | 10, 5 | 6, 5 |
| Монооксид углерода | 20, 9 | 19, 0 | 21, 2 | 25, 9 | 8, 0 |
Как следует из табл. 4.5, снижение доли воздуха в смеси углеводород – воздух приводит к увеличению выхода кислородсодержащих органических соединений и соответственно снижению выхода оксидов углерода.
Высшие алканы (С 10 и выше) окисляют в соответствующие спирты, из которых затем получают алкилсульфаты, необходимые для производства синтетических моющих средств (СМС). При этом в качестве катализатора применяют ортоборную кислоту (Н 3 ВО 3).
Твердые алканы окисляют в карбоновые кислоты при использовании в качестве катализатора смеси стеаратов Мп +2, Со +2, Fe +3 и К + или Nа +. При температуре 100–130 оС. Полученные при этом синтетические жирные кислоты (СЖК) применяют для получения мыла, пластических смазок, пластификаторов, эмульгаторов, стабилизаторов и ингибиторов коррозии.
4.5.3. Галогенирование алканов. Подобные реакции относят к радикально-цепным. Различают термическое, фотохимическое и инициированное галогенирование. Схема процесса с хлором такова:
h  (t)
(t)
 Сl2 Cl
Сl2 Cl  + Cl
+ Cl  ; (4.19)
; (4.19)
 Cl
Cl  + RH R
+ RH R  + HCl; (4.20)
+ HCl; (4.20)
 R
R  +2 Cl
+2 Cl  RCl + Cl
RCl + Cl  ; (4.21)
; (4.21)
 Cl
Cl  + Cl
+ Cl  Cl2. (4.22)
Cl2. (4.22)
Наиболее реакционноспособным является водород при третичном атоме углерода, затем при вторичном атоме и потом при первичном атоме углерода.
Наибольшее практическое применение имеют хлорпроизводные соединения метана и этана – хлористый метил (СН3Сl); хлористый метилен (СН2Сl2); хлороформ (СНСl3); четыреххлористый углерод (ССl4); 1, 2-дихлорэтан (СН2Сl – CH2Cl) и 1, 1, 1-трихлорэтан (ССl3 – CH3).
Продукт частичного замещения водорода хлором во фракции алканов С10 – С18 используют в производстве алкиларилсульфонатов, которые далее применяют в производстве СМС.
Пример реакции получения алкиларилсульфонатов:
AlCl3 H2SO4 NaOH


 С12Н25Сl + C6H6 С12Н25 – C6H5 С12Н25C6H4SO3H
С12Н25Сl + C6H6 С12Н25 – C6H5 С12Н25C6H4SO3H
– HCl – H2O – H2O
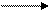 С12Н25 – C6H4 – SO3Na (4.24)
С12Н25 – C6H4 – SO3Na (4.24)
моющее средство (ПАВ)
Наиболее активен в реакциях галогенирования фтор. Он, как правило, замещает в углеводороде все атомы водорода, причем реакции с фтором протекают с рекордными тепловыми эффектами. Наименее активен в реакциях галогенирования бром. Подобные реакции с ним возможны при нагревании. Йод совершенно инертен к реакциям галогенирования.
4.5.4. Сульфирование алканов. Концентрированная серная кислота (олеум) при нагревании медленно сульфирует изоалканы:
 СН3 – СН – С2Н5 SO3H
СН3 – СН – С2Н5 SO3H


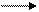
 + Н2SO4 CH3 – C C2H5 + Н2О. (4.25)
+ Н2SO4 CH3 – C C2H5 + Н2О. (4.25)
CН3 CH3
4.5.6. Сульфохлорирование. Эта реакция протекает при облучении реагентов ультрафиолетовым светом:
h 
 RH + SO2 + Cl2 RSO2Cl + HCl. (4.26)
RH + SO2 + Cl2 RSO2Cl + HCl. (4.26)
4.5.7. Сульфоокисление. Под действием УФ-облучения нормальные алканы вступают в реакцию:
h 
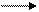 RH + SO2 + 1/2O2 RSO3H. (4.27)
RH + SO2 + 1/2O2 RSO3H. (4.27)
Сульфоокислению подвергают н-алканы от С 10 и выше. Алкены и арены не только не вступают в эту реакцию, но и тормозят ее.
4.5.8. Нитрование. Газофазное окисление алканов азотной кислотой протекает по следующему механизму:
 HONO2 HО
HONO2 HО  + NO2
+ NO2  ; (4.28)
; (4.28)
 CH3CH3 + HО
CH3CH3 + HО  CH3CH2
CH3CH2  + H2O; (4.29)
+ H2O; (4.29)
 CH3CH2
CH3CH2  + NO2
+ NO2  CH3CH2NO2; (4.30)
CH3CH2NO2; (4.30)
 CH3CH2
CH3CH2  + HONO2 CH3CH2NO2 + HO
+ HONO2 CH3CH2NO2 + HO  и т. д. (4.31)
и т. д. (4.31)
Промышленный процесс нитрования проводят при 450 оС и при следующем соотношении углеводорода и азотной кислоты: (5–10): 1 моль/моль. При нитровании, например, пропана образуются все четыре возможные нитропроизводные алканов:
NO2
 |
О2N – CH2 – CH2 – CH3; CH3 – CH – CH3; О2N – CH2 – CH3; О2N – CH3.
1-нитропропан 2-нитропропан нитроэтан нитрометан
Термические и термокаталитические превращения алканов, имеющие место в нефтепереработке, будут рассмотрены при изучении соответствующих процессов.
Контрольные вопросы
1. Какие алканы, содержащиеся в нефтях, относятся к газообразным, жидким и твердым? Приведите химические формулы.
2. Как распределяются алканы по фракциям нефти? От каких факторов зависит соотношение изомерных алканов в нефтях различных месторождений? Какие изоалканы содержатся в нефтях в наибольшем количестве?
3. В каком количестве представлены алканы в природном и попутном газах? Какие алканы в этих газах содержатся в наибольшем количестве? Какие газы, кроме углеводородов, могут содержаться в природном газе? Какова доля алканов в нефтезаводских газах различных процессов?
4. Какие вещества растворяются в жидких алканах? В каких растворителях растворяются алканы?
5. Объясните на конкретном примере механизм неполного окисления алканов в соответствии с теорией Н. Н. Семенова и Н. М. Эммануэля.
6. Приведите реакции галогенирования алканов. Какова роль процессов галогенирования алканов в органическом синтезе? Приведите примеры наиболее важных галогенопроизводных углеводородов. Дайте сравнительный анализ химической активности различных галогенов в реакциях с алканами.
7. Приведите примеры реакций сульфирования, сульфохлорирования, сульфоокисления и нитрования алканов.