
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кинетика и механизм термических процессов
|
|
Термические реакции протекают в основном по радикально-цепному механизму. Его впервые предложил Ф. Райс (США), а теоретическую разработку совершил академик Н.Н. Семенов (СССР) в 1958 г., за которую он получил Нобелевскую премию по физике.
Как любой цепной процесс, термический распад включает три стадии: инициирование, продолжение цепи и обрыв цепи.
8.2.1. Инициирование цепи. Так как энергия разрыва связи С – С всегда меньше, чем С – Н (у этана соответственно 360 и 410 кДж/моль), то реакция распада алифатических углеводородов на радикалы осуществляется преимущественно по связи С – С. Это на практике означает, что при 600 оС соотношение констант скоростей распада этана по связям С – С и С – Н при одинаковых предэкспоненциальных множителях составляет примерно 1/1000. При этом следует отметить, что в нормальных алканах с длинной цепью энергия разрыва связей С – С и С – Н в середине молекулы всегда меньше, чем на краю. Так в молекуле н-октана она составляет 310 и
335 кДж/моль для связи С – С и 360 и 394 кДж/моль для связи С – Н соответственно. Связи С – С в циклоалканах устойчивее, чем в нормальных алканах. В циклогексане эта разница составляет 8 кДж/моль, а в циклопентане 25 кДж/моль.
Связи С – С и С – Н в алкенах у атома углерода с двойной связью значительно прочнее, а в 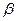 - положении существенно ослаблены, по сравнению с алканами:
- положении существенно ослаблены, по сравнению с алканами:
H H

 321
321


 R – CH2 – CH2 C C CH = CH2. (8.3)
R – CH2 – CH2 C C CH = CH2. (8.3)


 334 259 371
334 259 371
Н H
Энергия разрыва 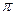 -связи в алкене при сохранении
-связи в алкене при сохранении 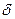 -связи равна 249 кДж/моль:
-связи равна 249 кДж/моль:
..
 СН2 = СН2 СН2 – СН2 – 249 кДж/моль. (8.4)
СН2 = СН2 СН2 – СН2 – 249 кДж/моль. (8.4)
Если двойная связь сопряженная, то энергия разрыва этой связи существенно меньше:
СН2 = СН – СН = СН2 – 188 кДж/моль. (8.5)
В аренах связи С – С и С – Н прочнее, чем в алканах, но связь, сопряженная с ароматическим кольцом (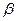 -связь), ослаблена:
-связь), ослаблена:
Н

 375 273
375 273


 С СН2 – СН2 – R (8.6)
С СН2 – СН2 – R (8.6)
 325
325
Н
При гомолитическом распаде связи происходит переход электронов двухэлектронной связи на орбитали разных атомов; при этом образуются либо два радикала, либо бирадикал:
 СН3 – СН3 2СН3
СН3 – СН3 2СН3  ; (8.7)
; (8.7)


 СН2 – СН2)4 – СН2
СН2 – СН2)4 – СН2  . (8.8)
. (8.8)
Радикалы могут возникать и по бимолекулярной реакции:
 С2Н4 + С3 Н6
С2Н4 + С3 Н6  С2Н5 + С3Н5
С2Н5 + С3Н5  ; (8.9)
; (8.9)
 С2Н6 + С2Н4 2С2Н5
С2Н6 + С2Н4 2С2Н5  .
.  (8.10)
(8.10)
Роль бимолекулярных процессов возрастает с повышением давления и снижением температуры.
8.2.2. Продолжение цепи. Радикалы обладают высокой реакционной способностью. Их стабильность снижается в ряду:
......
(C6H5)3 C > (C6H5)2CH > CH2 = CHCH2 > C6H5 – CH2 > (CH3)3C > C6H5 >
.
 CH3CH2CHCH3
CH3CH2CHCH3
..
> CH3CH2CH2 > CH2 = CH.
.
CH3
Различают следующие реакции радикалов.
1. Замещения (отрыв атома водорода).
..
 R + R/H RH + R/. (8.11)
R + R/H RH + R/. (8.11)
По правилу Поляни-Семенова энергия активации Е а реакций углеводородных радикалов с углеводородными молекулами связана с тепловыми эффектами реакций Q соотношением:
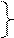 - для экзотермических реакций Еа = 48 – 0, 25Q кДж/моль
- для экзотермических реакций Еа = 48 – 0, 25Q кДж/моль
- для эндотермических реакций Еа = 48 – 0, 75Q
Для некоторых вариантов следующей реакции был сделан расчет Е а.
Q, 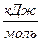 ; Ea,
; Ea, 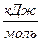
 СН4 + СН2 = СН – СН2
СН4 + СН2 = СН – СН2  75 29 (8.12)
75 29 (8.12)



 СН3 + СН2 = СН – СН3 СН4 + СН2 =
СН3 + СН2 = СН – СН3 СН4 + СН2 =  – СН3 - 9 54 (8.13)
– СН3 - 9 54 (8.13)
 СН4 +
СН4 +  СН = СН – СН3 - 9 54. (8.14)
СН = СН – СН3 - 9 54. (8.14)
При 700 оСи при одинаковых предэкспонентах реакция (8.12) протекает быстрее в 20 раз, чем реакции (8.13) и (8.14). Энергия активации алкильных радикалов с алканами составляет 40 – 50 кДж/моль.
2. Распад радикалов с образованием ненасыщенных молекул и новых свободных радикалов меньшей молекулярной массы. Распад протекает в основном по наиболее слабой связи, находящейся в 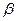 -положении относительно атома углерода с неспаренным электроном (
-положении относительно атома углерода с неспаренным электроном (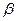 -правило).
-правило).
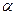 .
. 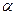
 ...
...
 СН3 – СН – СН – СН3 [CH3 – CH – CH2] + CH3 (8.15)
СН3 – СН – СН – СН3 [CH3 – CH – CH2] + CH3 (8.15)


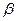
H CH3 – CH = CH2
или
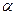 .
. 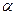
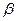 ...
...

 СН3 – СН – СН – СН3 [CH3 – CH – CH – СН3] + H. (8.16)
СН3 – СН – СН – СН3 [CH3 – CH – CH – СН3] + H. (8.16)

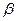
H CH3 –CH = CH – CH3
Реакции 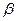 -распада эндотермичны. Энергия активации крупных радикалов (С 3 и выше) составляет 110 – 170 кДж/моль. Радикалы СН 3
-распада эндотермичны. Энергия активации крупных радикалов (С 3 и выше) составляет 110 – 170 кДж/моль. Радикалы СН 3 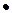 и С 2 Н 5
и С 2 Н 5 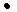 устойчивы к распаду. Если распад неразветвленного вторичного радикала может идти по нескольким направлениям, то энергетически более выгоден процесс, при котором получают радикал с наибольшей молекулярной массой.
устойчивы к распаду. Если распад неразветвленного вторичного радикала может идти по нескольким направлениям, то энергетически более выгоден процесс, при котором получают радикал с наибольшей молекулярной массой.
3. Присоединение радикала по кратной связи – процесс, обратный распаду:
..
 R + CH2 = CH – CH2R/ RCH2CHR/. (8.17)
R + CH2 = CH – CH2R/ RCH2CHR/. (8.17)
При этом выделяется 76–105 кДж/мольэнергии. А энергия активации, рассчитанная по правилу Поляни-Семенова, составляет 22 – 29 кДж/моль.
4. Изомеризация свободных радикалов. Предположительно протекает через циклическое переходное состояние:
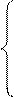

 СН2
СН2 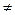
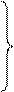
 Н2С Н СН3
Н2С Н СН3 
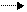



 СН3 – (СН2)5 – СН2 СН3СН2СН – (СН2)3СН3 (8.18)
СН3 – (СН2)5 – СН2 СН3СН2СН – (СН2)3СН3 (8.18)
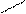
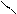 Н2С СН2 – СН2 1, 5-изомеризация
Н2С СН2 – СН2 1, 5-изомеризация
СН2
Изомеризация может происходить также в положении 1, 4-; 1, 6-; и
1, 7-. Трех- и четырехчленные циклы напряжены, и поэтому изомеризация в положениях 1, 2- и 1, 3- не происходит. Энергия активации реакции изомеризации составляет 50–90 кДж/моль. Сам процесс изомеризации протекает с небольшим тепловым эффектом.
Для аренов наблюдается 1, 2-переход фенильного радикала:
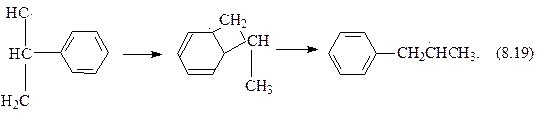
8.2.3. Обрыв цепи. Обрыв радикально-цепной реакции может происходить по следующим причинам.
1. Рекомбинация радикалов
 2С2Н5
2С2Н5  С4Н10. (8.20)
С4Н10. (8.20)
2. Диспропорционирование радикалов. Эта реакция – обратная бимолекулярной реакции образования радикалов.
 2С2Н5
2С2Н5  С2Н6 + С2Н4. (8.21)
С2Н6 + С2Н4. (8.21)
Энергия активации этой реакции равна 0. Кажущаяся энергия активации радикально-цепной реакции крекинга н-бутана равна 245 кДж/моль.
8.2.4. Соотношение скоростей радикальной реакции. При температурах выше 280 оС скорость реакции  -распада алкилрадикалов больше скорости замещения, вследствие чего длинные алкильные радикалы крекиру-ются. Для реакций радикалов с алкенами возможна конкуренция мономолекулярного распада с бимолекулярными реакциями присоединения и замещения. Направление и скорость реакции в этом случае в большой степени определяются давлением в системе. При температурах выше 727 оСи давлении0, 1 МПа бимолекулярные реакции не протекают. При 427 оС и 0, 1 МПа бимолекулярные реакции протекают замедленно, а при 427 оС и 1, 0 МПа бимолекулярные процессы преобладают.
-распада алкилрадикалов больше скорости замещения, вследствие чего длинные алкильные радикалы крекиру-ются. Для реакций радикалов с алкенами возможна конкуренция мономолекулярного распада с бимолекулярными реакциями присоединения и замещения. Направление и скорость реакции в этом случае в большой степени определяются давлением в системе. При температурах выше 727 оСи давлении0, 1 МПа бимолекулярные реакции не протекают. При 427 оС и 0, 1 МПа бимолекулярные реакции протекают замедленно, а при 427 оС и 1, 0 МПа бимолекулярные процессы преобладают.
Радикалы СН3  , С2Н5
, С2Н5  , С6Н5
, С6Н5  , С6Н5 – СН2
, С6Н5 – СН2  в условиях термокрекинга не распадаются; для них существуют только бимолекулярные реакции.
в условиях термокрекинга не распадаются; для них существуют только бимолекулярные реакции.