
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теплота растворения электролитов
|
|
| Электролит | Теплота растворения кДж/моль | Электролит | Теплота Растворения кДж/моль | |
| NaCl NaNO3 Na2SO4 NaOH Na2CO3 Na3PO4 | -17, 5 -36, 1 1, 3 10, 1 23, 5 61, 3 | MgCl2 MgSO4 MgNO3 | 146, 0 90, 9 85, 2 | |
| FeCl3 FeCl2 FeSO4 | 132, 4 78, 9 74, 8 | |||
| KCl KNO3 K2SO4 KOH K2CO3 KHPO4 | -17, 6 -17, 6 -25, 6 53, 6 27, 3 19, 9 | Al3(SO4)3 AlCl3 Al(OH)3 | - 9, 3 - | |
| HCl HNO3 H3PO4 H2SO4 | 73, 5 31, 5 22, 6 77, 3 | |||
| CaCl2 CaSO4 CaNO3 Ca3PO4 Ca(OH)2 | 73, 6 18, 1 16, 8 4, 2 12, 8 | |||
Так сильные основания, кислоты и соли легко диссоциируют в воде, их ионы активно взаимодействуют с молекулами воды, вследствии чего теплота их растворения высока. Причем с увеличением валентности катионов теплоа растворения возрастает.
Одновалентные катионы Na+ и К+ “гидрофобны”(точнее слабогидрофильны) они предпочитают активнее взаимодействовать с анионами, чем с молекулами воды, поэтому их соединения труднее растворяются в воде(с поглощением тепла.)
Гидратированные ионы имеющие противоположные заряд могут взаимодействовать друг с другом, образуя аквакомплексы.
Растворимость электролитов объясняется слабыми связями ионов (электролитов одновалентныъх катионов Na+, К+ и аионаов Cl-), их высокой гидрофильностью.
Истинные растворы – гомогенные системы, не способны образовывать структуры, как коллоидные растворы.
Удельная поверхность дисперсных истинных растворов в сотни-тысячи раз больше дисперсных коллоидных растворов. Поэтому абсолютная энергия ионов истинных растворов во много раз выше объемной энергии коллоидных частиц.
К истинным растворам относят щелочи, кислоты, и растворимые в воде соли, легко диссоциирующие в воде на ионы.
Щелочи - хорошо растворимые в воде основания. Чаще всего это соединения одновалентных металлов с гидроксиланионами:
Na – OН K – OН.
В качестве катионов электролитов-щелочей выступают одновалентные и двухвалентные металлы с большим ионным радиусом, например, Ва (ОН)2 (ионный радиус Ва2+ 1, 43 А°).
Основания двухвалентных металлов с малыми ионными радиусами в воде малорастворимы, например, Са(ОН)2 (ионный радиус Са 1, 06 А°), или нерастворимы, например, Мg(ОН)2 (ионный радиус Мg 0, 78 А°).
Кислоты - это химические соединения, диссоциирующие в воде с образованием в качестве катионов ионов водорода. К сильным кислотам относят кислоты со слабыми связями водорода с высокоотрицательными анионами: Cl, Вг, I, и кислородсодержащими анионными группами (при наличии в них не менее, двух атомов кислорода с двойными связями).
| О |
| N |
| Н |
| О |
| О |
| Н |
| S |
| О |
| О |
| О |
| О |
| Н |
| S |
Вследствие малых ионных радиусов металлоиды (S- 0, 35 А0, Р- 0, 35 А°, N - 0, 2 А°, С - 0, 2 А°) с высокоотрицательными атомами кислорода образуют прочные ковалентные связи (S–О 517 кДж/моль, Р-О 594 кДж/моль, С-О 1071 кДж/моль). Связи водорода с кислородсодержащими анионными группами несколько меньше чем у металлоида с кислородом. Электронное облако, вследствии высокой электроотрицательности кислорода, смещается в сторону несвязанного водородом кислорода с двойными связями.. Связь металлоида с кислородом становится полярной. На полюсе металлоида положительный, на полюсе кислорода - отрицательный заряд. Электронное облако кислорода, связанного с водородом, в свою очередь смещается в сторону металлоида, а прочность связи водорода с кислородом понижается.
| Н |
| О |
| С |
| Н |
| О |
| О |
Чем больше атомов кислорода с двойной связью, выше полярность аниона, тем ниже прочность связей водорода с анионной группой. Так, сильные кислородсодержащие кислоты имеют не менее двух таких атомов: H2S04, НNОз, НМnO4 и т.д.
Эффективность электролита определяется количеством ионов, появившихся в растворе при его диссоциации. Наиболее полно диссоциируют кислоты с одновалентными анионами (галогенами). Причем с увеличением ионного радиуса галогена прочность связей ионов понижается, степень диссоциации повышается.
Степень диссоциации в химии обычно определяют по константе диссоциации
 ,
,
где в числителе указаны концентрации ионов (продуктов диссоциации), а в знаменателе - концентрация недиссоциированных молекул.
Соли-электролиты - это соли со слабыми связями гидрофильных ионов между собой (соли кислот с одновалентными металлами). Их можно разделить на три группы: щелочные, кислотные и нейтральные.
К кислотным солям относят соли поливалентных металлов, после диссоциации активно взаимодействующих с молекулами воды и образующих в результате гидролиза ионы водорода Н+, например,
А1С1з=А13+ +ЗСl-
Al3++H2O=Al(OH)2++H+
Al(OH)2++ H2O= Al(OH)++H+
Al(OH)++ H2O = А1(ОН)3 + H+
К " нейтральным" солям относят соли со слабыми связями ионов в кристалле (соли с одновалентными анионами и катионами. слабо взаимодействующие с молекулами воды: NaCI, КСl и др.
К щелочным солям относят соли слабых кислот чаще одновалентных металлов с поливалентными анионами, способными образовывать (после диссоциации) в растворе связи с водородом воды и выделять ионы ОН- : карбонаты, нитраты фосфаты и др.
Na2CО3+Н2О=2Nа+НСО3+ +ОН-
Таблица 4.2
Растворимость кислот, оснований и солей в воде
| Анионы→ Катионы↓ | OH- | Cl- | Br- | I- | S2- | 
| 
| 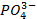
| 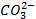
| 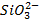
| NO3 | CH3COO- |
| H+ | P | P | P | P | P | P | P | P | H | P | P | |
| Li+ | P | P | P | P | P | P | P | H | P | P | P | P |
| K+ | P | P | P | P | P | P | P | P | P | P | P | P |
| Na+ | P | P | P | P | P | P | P | P | P | P | P | P |
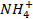 + +
| P | P | P | P | P | P | P | P | P | HC | P | P |
| Ba2+ | P | P | P | P | P | H | H | H | H | H | P | P |
| Ca2+ | M | P | P | P | P | H | , | H | H | H | P | P |
| Mg2+ | H | P | P | P | P | H | P | H | H | H | P | P |
| Al3+ | H | P | P | P | - | HC | P | H | HC | H | P | M |
| Cr3+ | H | P | P | P | - | HC | P | H | HC | - | P | P |
| Fe2+ | H | P | P | P | H | H | P | H | H | H | P | P |
| Fe3+ | H | P | P | HC | - | HC | P | H | HC | H | P | P |
| Ni2+ | H | P | P | P | H | H | P | H | H | - | P | P |
| Co2+ | H | P | P | P | H | H | P | H | H | - | P | P |
| Mn2+ | H | P | P | P | H | H | P | H | H | H | P | P |
| Zn2+ | H | P | P | P | HH | H | P | H | H | H | P | P |
| Ag+ | HC | H | H | H | H | H | M | H | H | HC | P | P |
| Hg+ | HC | H | H | H | H | HC | M | H | H | HC | P | M |
| Hg2+ | HC | P | M | H | H | HC | P | H | HC | HC | P | P |
| Pb2+ | H | M | M | H | H | H | H | H | H | H | P | P |
| Sn2+ | H | P | P | M | H | HC | P | H | HC | - | - | P |
| Cu2+ | H | P | P | HC | H | HC | P | H | HC | H | P | P |