
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кристаллизация растворов электролитов
|
|
Как отмечено выше гидрофильных ионов в водном растворе прочно связывается с молекулами воды, образуя гидраты катионов и анионов. Прочность связей ионов зависит от активности ионов и их концентрации С.
α = f ∙ C
В насыщенных растворах при понижении температуры раствора и снижении броуновского движения из гидратов поливалентных ионов образуются кристаллогидраты ионов. Гидрофильные (поливалентные) катионы образуют комплексные соединения (аквакомплексы) в которых в качестве лигандов выступают молекулы воды:
[Mg ∙ 6 H2O]2+ [Al ∙ 6 H2O]3+ и т.д.
Весьма активными анионы с высокоотрицательными атомами (азото - и кислородо - содержащими атомами) также образуют гидратные комплексы например,
[Fe ∙ 6 H2O]2+ [SO4 ∙ H2O]2-
В результате кулоновского взаимодействия комплексы соединяются друг с другом, образуя кристаллогидраты молекул (табл 4.4.)
Таблица 4.4
| KCl | NaCl | CaCl ∙ 6 H2O | FeCl2 ∙ 4 H2O |
| KNO3 | NaNO3 | Ca(NO3)2 ∙ 4 H2O | FeCl3 ∙ 6 H2O |
| K2SO4 | Na2SO4 ∙ 10 H2O | CaSO4 ∙ 2 H2O | FeSO4 ∙ 7 H2O |
| KOH ∙ 2 H2O | NaOH ∙ H2O | MgCl2 ∙ 6 H2O | Al(NO3)3 ∙ 9 H2O |
| K2CO3 ∙ 2 H2O | Na2CO3 ∙ 10 H2O | Mg(NO3)2 ∙ 6 H2O | Al2(SO4)3 ∙ 18 H2O |
| Na3PO4 ∙ 12 H2O | MgSO4 ∙ 7 H2O | H2(SO4) ∙ 4 H2O | |
Из таблицы видно, что электролиты представленные одновалентными катионами и одновалентными анионами кристаллогидратов не образуют
Из натриевых солей образуют кристаллогидраты соли с активными анионами 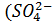 , РО4, СО3) и соли способные при растворении образовывать щелочи.
, РО4, СО3) и соли способные при растворении образовывать щелочи.
Из кальциевых солей хорошо растворяются соли с одновалентными анионами. С поливалентными анионами Ca2+ образует прочные связи соли слаборастворима и содержит в кристаллогидрате всего две молекулы воды. Соли с гидрофильными поливалентными катионами Mg2+, Fe2+, Fe3+, Al3+ и полярными поливалентными анионами хорошо растворяются в воде и активно образуют кристаллогидраты.