
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Спектр атома водорода по Бору
|
|
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем — систем, состоящих из ядра с зарядом Zeи одного электрона (например, ионы Не+, Li2+), а также теоретически вычислить постоянную Ридберга.
Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. Решая совместно уравнение (208.1) mev2/r = Ze2/(4pe0r2), предложенное Резерфордом, и уравнение (210.1), получим выражение для радиуса n-й стационарной орбиты:
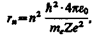
где n = 1, 2, 3,.... Из выражения (212.1) следует, что радиусы орбит растут пропорционально квадратам целых чисел.
Для атома водорода (Z = 1) радиус первой орбиты электрона при n = 1, называемый первым воровским радиусом (а), равен
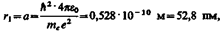
что соответствует расчетам на основании кинетической теории газов. Так как радиусы стационарных орбит измерить невозможно, то для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально. Такой величиной является энергия, излучаемая и поглощаемая атомами водорода.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии (mev2/2) и потенциальной энергии в электростатическом поле ядра (-Ze2/(4pe0r):
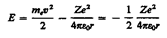
(учли, что  ; см. (208.1)). Учитывая квантованные для радиуса n-й стационарной орбиты значения (212.1), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
; см. (208.1)). Учитывая квантованные для радиуса n-й стационарной орбиты значения (212.1), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
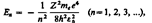
где знак минус означает, что электрон находится в связанном состоянии.
Из формулы (212.3) следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n. Целое число nв выражении (212.3), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n = 1 является основным (нормальным) состоянием; состояния с n > 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными.
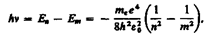
откуда частота излучения
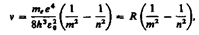 (212.4)
(212.4)
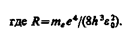
Воспользовавшись при вычислении R современными значениями универсальных постоянных, получим величину, совпадающую с экспериментальным значением постоянной Ридберга в эмпирических формулах для атома водорода (см. § 209). Это совпадение убедительно доказывает правильность полученной Бором формулы (212.3) для энергетических уровней водородоподобной системы.
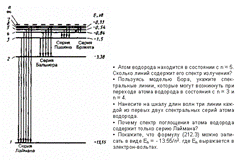
Спектр поглощения атома водорода является линейчатым, но содержит при нормальных условиях только серию Лаймана. Он также объясняется теорией Бора. Так как свободные атомы водорода обычно находятся в основном состоянии (стационарное состояние с наименьшей энергией при n = 1), то при сообщении атомам извне определенной энергии могут наблюдаться лишь переходы атомов из основного состояния в возбужденные (возникает серия Лаймана).