
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая кинетика. Одна из основных задач химии – изучение влияния различных факторов на скорость и механизм химических реакций
|
|
Одна из основных задач химии – изучение влияния различных факторов на скорость и механизм химических реакций. Этому посвящен особый раздел химии – химическая кинетика.
Реакции могут быть гомогенными и гетерогенными. Гомогенные реакции протекают в однородной среде (например, в газовой фазе или жидком растворе). Гетерогенные реакции протекают в неоднородной среде – между веществами, которые находятся в разных фазах (твердой и жидкой, газовой и жидкой и т. д.).
Таким образом, гомогенные реакции происходят равномерно во всем объеме, заполненном реагентами, гетерогенные – только на некоторых пограничных поверхностях – на границе раздела фаз.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела (для гетерогенных реакций).
Скорость реакции обычно характеризуют изменением концентрации какого-либо из исходных веществ или конечных продуктов реакции в единицу времени. Размерность – моль/(л ∙ с).
Если в момент времени т1 и т2 концентрации одного из исходных веществ равны С1 и С2, то средняя скорость v в интервале времени от т1 до т2 можно выразить как
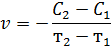
Поскольку концентрация реагирующего вещества во времени уменьшается, то С2 - С1 < 0. Но скорость не может быть отрицательной величиной, поэтому в правой части уравнения ставится «-». Если скорость определяют по увеличению концентрации продукта реакции, то она положительна. В общем случае
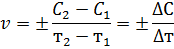
Эта формула выражает так называемую среднюю скорость реакции. Мгновенная скорость реакции выражается первой производной концентрации по времени
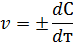
Иногда на практике применяется так называемая относительная скорость. Эта величина, обратная времени 1/т. Ее размерность 1/с.
Скорость реакции зависит от многих факторов. На нее влияют: природа и концентрация реагентов, давление (для реакции с участием газов), температура, катализатор и т. д.