
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задача 1. В соответствии с законом действия масс запишем выражения скоростей прямой и обратной реакций:
|
|
Дана система 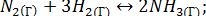 Δ H< 0. Рассчитать изменение скоростей прямой и обратной химических реакций, если объем системы уменьшить в 2 раза. Определить в каком направлении сместится равновесие, если: а) в системе повысить давление; б) понизить температуру; в) увеличить концентрацию водорода.
Δ H< 0. Рассчитать изменение скоростей прямой и обратной химических реакций, если объем системы уменьшить в 2 раза. Определить в каком направлении сместится равновесие, если: а) в системе повысить давление; б) понизить температуру; в) увеличить концентрацию водорода.
РЕШЕНИЕ:
В соответствии с законом действия масс запишем выражения скоростей прямой и обратной реакций: 
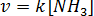 . Система гомогенная, все вещества находятся в газообразном состоянии. При уменьшении, объема системы в 2 раза концентрация реагентов возрастает также в 2 раза. Запишем новые выражения скоростей реакции:
. Система гомогенная, все вещества находятся в газообразном состоянии. При уменьшении, объема системы в 2 раза концентрация реагентов возрастает также в 2 раза. Запишем новые выражения скоростей реакции: 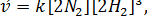
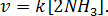 Следовательно, скорость прямой реакции возрастает в
Следовательно, скорость прямой реакции возрастает в  = 16 раз,
= 16 раз, 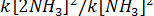 = 4 раз.
= 4 раз.
Константа равновесия данной реакции запишется следующим образом:
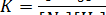
Если в системе повысить давление, то объем уменьшится, а концентрация реагентов возрастет. Следовательно, смещение равновесия произойдет в сторону реакции, уменьшающей концентрацию. Так как в данной реакции в левой части уравнения 4 моль вещества, а в правой - 2 моль, то смещение равновесия будет вправо.
Реакция экзотермическая, то есть идет с выделением тепла. Если понизим температуру, то смещение равновесия произойдет вправо, в сторону экзотермической реакции.
При увеличении концентрации водорода смещение равновесия произойдет в сторону реакции, уменьшающей концентрацию водорода, в данном случае вправо.
Задача 2.
Как изменится скорость реакции при повышении температуры от 20°С до 60°С, если температурный коэффициент скорости реакции равен 2?
РЕШЕНИЕ:
Для решения применим правило Вант-Гоффа:
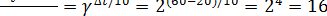
Следовательно, скорость реакции при повышении температуры возрастет в 16 раз.
Задача 3.
При температуре 50°С некоторая реакция заканчивается за 2 мин. 15 с. Принимая температурный коэффициент скорости реакции равным 3, рассчитать, через какое время закончится эта реакция, если проводить ее при 70°С?
РЕШЕНИЕ:
По правилу Вант-Гоффа рассчитаем, во сколько раз изменится скорость реакции 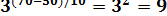 . Значит отношение
. Значит отношение  равно 9. Скорость реакции обратно пропорциональна времени реакции. Следовательно, можно записать
равно 9. Скорость реакции обратно пропорциональна времени реакции. Следовательно, можно записать  . Отсюда находим
. Отсюда находим  .
.
Задача 4.
Найти температурный коэффициент скорости реакции, если известно, что при повышении температуры на 80º С скорость реакции возросла в 3000 раз.
РЕШЕНИЕ:
Применяя правило Вант-Гоффа, получим 
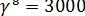 . Прологарифмировав это выражение, найдем, что
. Прологарифмировав это выражение, найдем, что 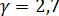 .
.
Задача 5.
Как изменится скорость прямой реакции 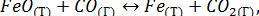 если уменьшить объем системы в 2 раза.
если уменьшить объем системы в 2 раза.
РЕШЕНИЕ:
Так как система гетерогенная, то учитывается изменение концентрации вещества в газовой фазе. В соответствии с законом действия масс скорость прямой реакции  . При уменьшении объема системы в 2 раза концентрация СО увеличится также в 2 раза. Скорость прямой реакции станет
. При уменьшении объема системы в 2 раза концентрация СО увеличится также в 2 раза. Скорость прямой реакции станет 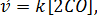 то есть увеличится в 2 раза.
то есть увеличится в 2 раза.
Задания для самостоятельной работы:
| № варианта | Определить тип системы: гомогенная или гетерогенная | Рассчитать изменения скоростей прямой и обратной химических реакций после изменения условий. Скорость, какой реакции станет больше? | Определить тип реакции: экзотермическая или эндотермическая. Решить задачу согласно условию. | Написать выражение константы равновесия для данной системы. Пользуясь принципом Ле Шателье, объяснить, в каком направлении сместится равновесие после изменения условий. |
| 1. | H2(Г)+S(T)↔ H2S(Г); Δ H< 0 | Уменьшить объем системы в 3 раза. | Увеличить температуру. | |
| 2. | C2H4(Г)+3O2(Г)↔ 2CO2(Г)+2H2O(Г); Δ H< 0 | Увеличить концентрацию кислорода в 2 раза и воды в 3 раза. | Уменьшить температуру. | |
| 3. | H2(Г)+CO2(Г)↔ CO(Г)+H2O(Ж); Δ H< 0 | Увеличить концентрацию CO2 и H2 в 3 раза. | Уменьшить температуру. | |
| 4. | А(Г)+2В(Т)↔ С(Г); Δ Н> 0 | Во сколько раз изменится скорость реакции, если температуру понизить на 70º С, γ =2. | Увеличить концентрацию вещества А. | |
| 5. | Fe3O4(T)+CO(Г)↔ 3FeO(T)+CO2(Г); Δ H> 0 | Увеличить давление в 4 раза | Уменьшить концентрацию CO2 | |
| 6. | 2SO2(Г)+O2(Г)↔ 2SO3(Г); Δ H< 0 | Увеличить объем системы в 3 раза. | Увеличить температуру | |
| 7. | 2H2S(Г)+O2(Г)↔ 2H2O(Г)+2S(T) | Уменьшить объем системы в 2 раза | Увеличить концентрацию воды | |
| 8. | А(Т)+В(Г)↔ С(Г) | Как изменится скорость реакции, если увеличить температуру на 40º С, γ =3 | Увеличить концентрацию вещества С | |
| 9. | 4NH3(Г)+3O2(Г)↔ 2N2(Г)+6H2O(Ж); Δ H< 0 | Уменьшить концентрацию аммиака и кислорода в 2 раза | Увеличить температуру | |
| 10. | PCl5(Г)↔ PCl3(Г)+Cl2(Г) | Увеличить давление в 3 раза | Увеличить объем системы | |
| 11. | FeO(T)+H2(Г)↔ Fe(T)+H2O(Г) | Увеличить концентрацию Н2 в 4 раза | Уменьшить объем системы | |
| 12. | СН4(Г)+СО2(Г)↔ 2СО(Г)+2Н2(Г); Δ Н> 0 | Уменьшить давление в системе в 2 раза | Увеличить температуру | |
| 13. | А2(Г)+2В(Т)↔ 2АВ(Г) | При температуре 50º С реакция заканчивается за 10 с. Сколько времени будет длиться реакция при 20º С, если γ =2 | Увеличить давление | |
| 14. | С(Т)+О2(Г)↔ 2СО(Г); Δ < 0 | Уменьшить давление в системе в 3 раза | Уменьшить температуру | |
| 15. | MgCO3(Т)↔ MgO(T)+CO2(Г); Δ H> 0 | Уменьшить концентрацию СО2 в 4 раза | Увеличить температуру | |
| 16. | 3Fe(T)+4H2O(Г)↔ Fe3O4(T)+4H2(Г) | Увеличить объем системы в 2 раза. | Увеличить концентрацию Н2 | |
| 17. | СОCl2(Г)↔ СО(Г)+Cl2(Г) | Уменьшить давление в системе в 3 раза | Увеличить температуру | |
| 18. | 4СО(Г)+2SO2(Г)↔ 2S(T)+4CO2(Г); Δ H< 0 | Уменьшить объем системы в 2 раза. | Увеличить температуру | |
| 19. | А(Г)+В(Г)↔ 2С(Т) | Как изменится скорость реакции, если увеличить температуру на 60º С, γ =2 | Уменьшить концентрацию вещества А | |
| 20. | HCl(Г)+O2(Г)↔ Н2О(Г)+2Cl2(Г); Δ Н< 0 | Увеличить концентрацию исходных веществ в 4 раза | Уменьшить температуру | |
| 21. | NH3(Г)+HCl(Г)↔ NH4Cl(Т) | Уменьшить концентрацию аммиака в 3 раза | Увеличить давление | |
| 22. | 3N2O(Г)+3NH3(Г)↔ 4N2(Г)+3Н2О(Г); Δ Н< 0 | Увеличить давление в системе в 2 раза | Уменьшить температуру | |
| 23. | C2H5OH(Ж)+3О2(Г)↔ 2СО2(Г)+3Н2О(Ж); Δ Н< 0 | Уменьшить давление в системе в 2 раза | Увеличить температуру | |
| 24. | А(Т)+2В(Г)↔ С(Т) | Во сколько раз увеличится скорость реакции при повышении температуры на 30º С, γ =3. | Уменьшить концентрацию вещества В в 2 раза | |
| 25. | S(T)+O2(Г)↔ 2SO2(Г); Δ H< 0 | Увеличить концентрацию кислорода в 3 раза | Уменьшить температуру | |
| 26. | CH4(Г)+4Cl2(Г)↔ CCl4(Ж)+4HCl(Г); Δ H< 0 | Уменьшить концентрацию в 2 раза | Увеличить температуру | |
| 27. | А(Г)+В(Г)↔ С(Ж) | При температуре 70º С реакция заканчивается за 15 с. Сколько времени будет длиться эта реакция при 40º С, γ =2 | Увеличить концентрацию исходных веществ в 5 раз | |
| 28. | N2(Г)+О2(Г)↔ 2NO(Г); Δ H> 0 | Уменьшить давление в системе в 3 раза | Увеличить температуру | |
| 29. | 2H2(Г)+О2(Г)↔ 2Н2О(Г); Δ H< 0 | Уменьшить объем системы в 2 раза. | Увеличить температуру | |
| 30. | N2(Г)+3Н2(Г)↔ 2NH3(Г); Δ H< 0 | Увеличить давление в системе в 3 раза | Увеличить концентрацию аммиака в 5 раз |
Список использованной литературы
1. Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия, 1981. 632 с.
2. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.: Мир, 1982. 652 с.
3. Глинка Н. Л. Общая химия. Л.: Химия, 1987. 702 с.
4. Глинка Н. Л. Задачи и упражнения по общей химии. Л.: Химия, 1987. 260 с.
5. Хомченко Г. П. Химия. Для подготовительных отделений. М.: Высшая школа, 1980. 368 с.