
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Зависимость скорости реакции от природы реагирующих веществ
|
|
Значительное ускорение процесса при нагревании можно было бы объяснить учащением соударений реагирующих частиц. Но если бы необходимым и достаточным условием протекания реакций являлось лишь соударение частиц, то нельзя было бы объяснить различие в скоростях процессов при одинаковых концентрациях реагентов. Если бы каждое столкновение оканчивалось актом взаимодействия, то все реакции протекалибы со скоростью взрыва. Было бы непонятно также действие катализатора, его специфичность и многое другое.
Значит далеко не каждое столкновение частиц приводит к их химическому взаимодействию. Рассмотрим две реакции в нормальных условиях
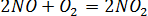
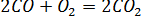
Несмотря на то, что обе реакции являются реакциями окисления и протекают в газовой фазе, в первом случае реакция протекает с большой скоростью, а во втором случае практически не идет.
Взаимодействие происходит в том случае, когда частица приближается на расстояние, при котором становится возможным перераспределение электронной плотности и возникновение новых химических связей. Следовательно, сталкивающиеся частицы должны обладать энергией, достаточной для преодоления сил отталкивания (энергетического барьера), возникающих между их электронными оболочками. Такие реакционные частицы называют активными, а энергия, необходимая для преодоления энергетического барьера – энергия активации реакции. Группировку частиц, находящихся в процессе взаимодействия (т. е. перераспределения связей), называют активным комплексом. Это неустойчивое промежуточное соединение, которое ослабляет связи атомов в исходных молекулах, т.к. для создания возможности протекания реакции нет необходимости полностью разрывать связи между атомами. Следовательно, энергия активации всегда меньше энергии связей.
Разность энергии активированного комплекса и средней энергии исходных молекул и есть энергия активации. Ее величина является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Зависимость константы скорости реакции k от энергии активации (Еа, Дж/моль) выражается уравнением Аррениуса:
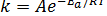
где А – предэкспоненциальный множитель или фактор частоты; R – универсальная газовая постоянная; е – основание натуральных логарифмов.
Если энергия активации меньше 40 кДж/моль, то скорость такой реакции велика; если больше 120 кДж/моль, то скорость такой реакции очень мала.