
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Цепные реакции
|
|
В природе существует многочисленные реакции, которые не подчиняются уравнению Аррениуса, закону действующих масс. Скорости протекания таких реакций нельзя объяснить ни одной теорией кинетики, уравнениями формальной кинетики. Это и есть цепные реакции.
Цепными реакциями называется реакции, протекающие с участием химически активных частиц (свободные атомы и радикалы) и состоящие из большого количества повторяющихся стадий. К цепным реакциям относятся реакции горения, медленного окисления, радиоактивного распада, передачи нервного импульса, ядерные реакции и т.д.
К характерным особенностям цепных реакций относятся:
1) скорость реакции не совпадает со скоростью, вычисленной по теории активных соударений, т.е. Wнаблюдаемая > > Wрасчета;
2) исключительная чувствительность к примесям положительных и отрицательных катализаторов, которые ускоряют или замедляют реакцию;
3) зависимость скорости реакции от размеров, формы, материалов сосуда. В сосуде большего объема скорость реакции больше. Скорость реакции замедляется, если в свободное пространство поместить осколки кварца, стекла, фарфора и т.п.
4) Наличие нижнего и верхнего пределов воспламенения или взрыва для реакций окисления газов, ниже и выше которых реакции идут медленно или вообще не идут.
Особенности протекания этих реакций объясняется цепным механизмом реакции, в разработку которого существенный вклад был внесен академиком Н.Н. Семеновым (рис. 5.6). Активная частица “А”, образовавшаяся путем столкновения или любым другим путем, может дезактивироваться, но может дать промежуточное вещество “Z”, которое в свою очередь может разложиться без образования продуктов или дать продукты реакции и новую активную частицу. При этом, активация одной молекулы исходных веществ приводит к образованию большого количества молекул продуктов реакции.
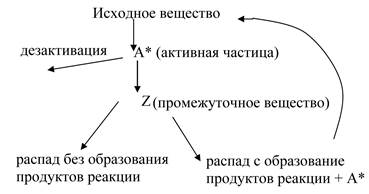
Рис. 5.6. Схема цепной реакции
Основные положения теории цепных реакций:
1) в реакции участвуют атомы или свободные радикалы (частицы, имеющие не спаренный электрон). Атом или свободный радикал обладают исключительной активностью по отношению к валентно-насыщенной молекуле;
2) при взаимодействии валентно-насыщенной молекулы с атомом или свободным радикалом “свободная валентность” не исчезает, а дает начало новой активной частице (принцип неучтожимости свободной валентности).
Под “свободной валентностью” надо понимать частицы, имеющие неспаренный электрон (атом или свободный радикал).
Основные стадии цепной реакции:
1) зарождение цепи - элементарная стадия цепной реакции, приводящая к образованию свободной валентности из валентно-насыщенной молекулы;
2) продолжение или развитие цепи - элементарная стадия, идущая с сохранением свободной валентности и приводящая к расходованию исходных веществ и образованию продуктов реакции;
3) обрыв цепи - элементарная стадия, приводящая к исчезновению свободной валентности.
Пример цепной реакции - синтез HCl.
H2 + Cl2 = 2HCl
1. Зарождение цепи (возбуждение, инициирование):
Cl2 + hν = 2Cl ˙ (Eдиссоц Cl2 = 57 кал/моль),
H2 + hν = 2H ˙ (Едиссоц H2 = 103, 3 кал/моль).
Так как энергия связи молекулы хлора ниже, то зарождение цепи идет за счет диссоциации молекул Cl2.
2. Продолжение или развитие цепи:
Cl ˙ + H2 = HCl + H ˙,
H ˙ +Cl2 = HCl + Cl ˙, т.е. свободная валентность не исчезает.
3. Обрыв цепи:
H ˙ + H ˙ + стенки = H2
Сl ˙ +Cl ˙ + стенки = Cl2
H ˙ +Cl ˙ + стенки = HCl
Возможен обрыв цепи за счет рекомбинации свободных радикалов (гомогенный процесс) и гетерогенный процесс - обрыв цепи за счет стенок сосуда. В рассмотренном примере цепной реакции каждая активная частица дает начало одной цепи - это стационарная неразветвленная цепная реакция.
Разветвленные цепные реакции – это реакции, в которых стадия развития цепи протекает с увеличением числа “свободных валентностей”. Схема ее выглядит следующим образом:
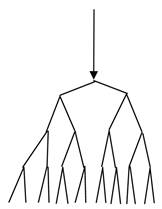
Рис. 7. Схема разветвленной реакции.
Пример разветвленной реакции - синтез воды при высокой температуре.
2H2 + O2 = 2H2O
1. Зарождение цепи: H2 + O2 = 2OH ˙,
OH ˙ + H2 = H2O + H ˙
2. Развитие цепи: H ˙ + O2 = OH ˙ + Ö (бирадикал)
Ö + H2 = OH ˙ + H ˙,
H ˙ + O2 + Н2 = 2OH ˙ + H ˙ - стадия развития цепи.
Из одной активной частицы получается несколько, каждая из которых дает начало своей цепи.
3. Обрыв цепи: 2H ˙ = H2
2Ó H = H2O2