
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кинетика гетерогенных процессов
|
|
Гетерогенными называются процессы, протекающие на поверхности раздела соприкасающихся фаз. Все эти процессы являются многостадийными процессами. По меньшей мере, они состоят из трех стадий: 1) подвод молекул реагирующих веществ к поверхности раздела; 2) взаимодействие на поверхности раздела; 3) отвод продуктов реакции с поверхности раздела вглубь данной фазы. Некоторые химики полагают, что механизм гетерогенного катализа включает пять стадий, причем все они обратимы: 1) диффузия веществ к поверхности твердого катализатора; 2) адсорбция реагентов на поверхности катализатора; 3) химическая реакция; 4) десорбция продуктов реакции; 5) диффузия веществ от поверхности катализатора.
Так как эти стадии протекают последовательно, то скорость суммарного процесса определяется наиболее медленной стадией. Рассмотрим влияние температуры на константу скорости гетерогенной реакции (рис. 5.8.).
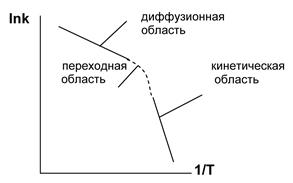
Рис. 5.8. Зависимость логарифма константы скорости
от обратной температуры
Если определяющей стадией является химическая реакция на поверхности раздела фаз, то гетерогенный процесс описывается законными химической кинетики и, следовательно, протекает в кинетической области (для кинетической области энергия активации Е=50¸ 200кДж/моль, температурный коэффициент γ =2¸ 4). Если, как это чаще бывает, наиболее медленно совершается подвод и отвод соответствующих веществ, то гетерогенный процесс описывается законами диффузии, т.е. он протекает в диффузионной области (для диффузионной области Е=5¸ 20 кДж/моль, γ = 1, 1¸ 1, 4).
Температура сильнее влияет на скорость химических процессов, чем на диффузию, так как энергия активации химических реакций значительно больше энергии активации диффузионных процессов.
Диффузия в гетерогенном процессе имеет большое значение, поскольку за счет ее происходит изменение концентрации в приповерхностном слое, влияющее на кинетику процесса. Диффузия – это процесс, посредством которого вещество перераспределяется из области с высокой концентрацией или высоким давлением в область с меньшей концентрацией или давлением.
Диффузия описывается законами Фика. Первый закон Фика: масса вещества (dm), переносимая путем диффузии в направлении оси “х” через перпендикулярную этому направлению площадку, пропорциональна площади этой площади (S), времени (dt) и градиенту концентраций (dc/dx) вдоль выбранного направления.
dm = (-D·S·dc/dx)·dt или υ D = dm/dt = -D·S·dc/dx,
где D - коэффициент диффузии, υ D - скорость диффузии. Знак минус показывает, что процесс диффузии происходит от большей концентрации к меньшей.
Коэффициент диффузии зависит от температуры, для жидких и газовых сред он увеличивается с ростом температуры на 10º примерно на 20%. Единицы измерения коэффициента диффузии - [площадь/время]: см2/с, см2/сутки, см2/год.
Характер зависимости коэффициента диффузии от температуры приближенно описывается уравнением, аналогичным уравнению Аррениуса:
D = D0e-E/RT,
D0 - величина, не зависящая от температуры.
Вопросы для собеседования
1. Скорость химических реакций. Средняя и истинная скорости. Закон действующих масс. Константа скорости.
2. Молекулярность и порядок реакции. Кинетическое уравнение первого порядка, период полураспада.
3. Кинетические уравнения второго и нулевого порядков. Период полураспада.
4. Методы определения константы скорости и порядка реакции.
5. Влияние температуры на константу скорости химических реакций. Температурный коэффициент. Правило Вант-Гоффа. Уравнение Уррениуса. Расчет энергии активации.
6. Теория активных соударений. Вероятностный или стерический фактор. Энергия активации. Источники активации.
7. Основные типы сложных реакций: обратимые, параллельные, последовательные и сопряженные.
8. Цепные реакции.
9. Фотохимические реакции. Фотохимические законы.
10. Катализ. Особенности каталитических процессов. Типы катализа.
11. Кинетика гетерогенных процессов.