
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задачи на нахождение израсходованных, образовавшихся концентраций с использованием стехиометрических схем.
|
|
Пример 1 – Реакция идет по уравнению 2Н2(Г)+O2(Г) = 2Н2O(Г). Концентрации исходных веществ до начала реакции – [Н2]ИСХ = 0, 06 моль/л, [O2]ИСХ = 0, 02 моль/л. Вычислить концентрации этих веществ в момент, когда [Н2O] = 0, 01 моль/л.
Решение
Прежде чем перейдем к решению задач, напомним, что в реакции
2Н2(Г)+O2(Г) = 2Н2O(Г)
Н2(Г) и O2(Г) относятся к исходным веществам, концентрация которых с течением времени уменьшается по мере того, как эти вещества расходуются, а Н2O(Г) – к продуктам реакции, концентрация которой с течением времени увеличивается по мере того, как эти вещества образуются.
Следует различать концентрации начальные (или исходные) – [ ]НАЧ, образовавшиеся – [ ]ОБР, израсходованные – [ ]ИЗР, равновесные – [ ]Р, и в момент времени t – [ ]t.
[ ]НАЧ – концентрации в начальный момент времени, моль/л.
[ ]ОБР – образовавшиеся в единице объема в ходе реакции, моль/л.
[ ]ИЗР – израсходованные в единице объема в ходе реакции, моль/л.
[ ]Р – концентрации в момент наступления равновесия, моль/л. Для исходных веществ – это то, что осталось к моменту наступления равновесия, т. е. разность между начальной и израсходованной; для продуктов реакции – сумма начальной и образовавшейся концентраций.
[ ]t – концентрации в определенный момент времени t, моль/л.
Так как начальная концентрация Н2О не указана, принимаем ее равной нулю. Концентрация воды в момент времени t – [Н2] t = 0, 01 моль/л – есть образовавшаяся концентрация. Для нахождения образовавшихся и израсходованных концентраций используем стехиометрические схемы.
По уравнению реакции
2Н2(Г) + O2(Г) = 2Н2O(Г)
2 моль 1 моль 2 моль
׀ ׀
׀ х моль –––––– 0, 01 моль
׀
у моль –––––––––––––– 0, 01 моль
Поскольку по условию задачи в каждом литре системы образовалось 0, 01 моля Н2О (г), то при этом было израсходовано 0, 005 моль О2:
1 моль О2 –––– 2 моль Н2О
х моль –––––– 0, 01 моль
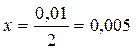 моль/л – это есть [О2]ИЗР.
моль/л – это есть [О2]ИЗР.
Так как в каждом литре системы образовалось 0, 01 моля Н2О (г), то при этом было израсходовано 0, 01 моль Н2:
2 моль Н2 соответствует 2 моль Н2О
у моль ––––––––––––––– 0, 01 моль
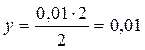 моль/л – речь идет об [Н2]ИЗР.
моль/л – речь идет об [Н2]ИЗР.
Тогда искомые концентрации равны:
[О2]t = [О2]НАЧ – [О2]ИЗР = 0, 02 – 0, 005 = 0, 015 моль/л;
[Н2]t = [Н2]НАЧ – [Н2]ИЗР = 0, 06 – 0, 01 = 0, 05 моль/л.
Пример 2 – До начала реакции концентрации исходных веществ в гомогенной системе K+2L = 3M+N былиравны: [K]= 0, 5 моль/л, [L]= 0, 12 моль/л. Найти концентрации всех веществ на тот момент времени, когда концентрация L уменьшилась в три раза.
Решение
При уменьшении концентрации L в 3 раза, в момент времени t [L]t = [L]НАЧ / 3 = 0, 12 / 3 = 0, 04 моль/л. Следовательно, в ходе реакции израсходовалось некоторое количество вещества L: [L]ИЗР = [L] НАЧ – [L]t = 0, 12 – 0, 04 = 0, 08 моль/л. В случае определения концентрации вещества К следует помнить, что вещество L не расходуется само по себе, а вступает в реакцию с К в соотношении 2 к 1т. е. 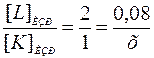 , отсюда х = 0, 04 моль/л.
, отсюда х = 0, 04 моль/л.
Значит, в момент времени t концентрация вещества К будет равна
[К] t = [К]НАЧ – [К]ИЗР = 0, 5 – 0, 04 = 0, 46 моль/л.
Также можно найти и образовавшиеся концентрации M и N:
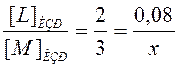 , отсюда х = 0, 12 моль/л.
, отсюда х = 0, 12 моль/л.
Концентрацию вещества N можно найти таким же образом по концентрации K или L, а можно и полученной концентрации М:
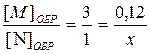 , отсюда х = 0, 04 моль/л.
, отсюда х = 0, 04 моль/л.
Поскольку не были даны исходные концентрации этих веществ, то мы можем считать, что начальная концентрация продуктов реакции равна нулю. Следовательно, на момент времени t, когда концентрация L уменьшилась в 3 раза, [К]t = 0, 46 моль/л; [M]t = 0, 12 моль/л; [N]t = 0, 04 моль/л.