
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задачи с использованием константы химического равновесия.
|
|
Пример 1 – При некоторой температуре равновесие в гомогенной системе 2A+B «2C+4D установилось при следующих концентрациях: [A] = 0, 16 моль/л, [B] = 0, 05 моль/л, [D] = 0, 08 моль/л. Найти константу равновесия реакции и исходные концентрации [А] и [B].
Решение
Запишем формулу константы равновесия, учитывая концентрации всех веществ, т. к. система является гомогенной:
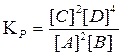
Но нам не известна концентрация C. Её мы можем найти по уравнению реакции, используя стехиометрические схемы (см. раздел 1.2.3):
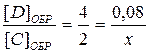 , отсюда х = 0, 04 моль.
, отсюда х = 0, 04 моль.
Подставим данные в формулу и рассчитаем значение константы:
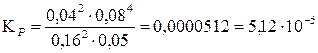 .
.
Чтобы найти исходные концентрации веществ А и В, нужно определить, какое количество этих веществ израсходовалось в ходе химической реакции:
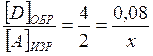 или
или 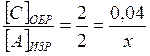 , но в любом случае х = 0, 04 моль/л;
, но в любом случае х = 0, 04 моль/л;
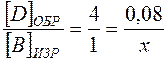 или
или 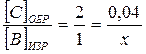 , или
, или 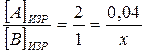 ,
,
отсюда х = 0, 02 моль/л.
Поскольку в этой реакции А и В относятся к исходным веществам, концентрация которых с течением времени уменьшается по мере того, как эти вещества расходуются, то их исходная (начальная) концентрация будет больше равновесной.Отсюда
[A]НАЧ = [A]Р + [A]ИЗР = 0, 16 + 0, 04 = 0, 2 моль/л;
[В]НАЧ = [В]Р + [В]ИЗР = 0, 05 + 0, 02 = 0, 07 моль/л.
Пример 2 – Найдите равновесные концентрации всех реагирующих веществ в гетерогенной системе 2L(Г) + M(К) «N(Г)+ Q(Г), если известно, что константа химического взаимодействия равна 1, а исходные концентрации [ L ] = 0, 5 моль/л и [ Q ] = 0, 2 моль/л.
Решение
Учитывая, что система гетерогенная (опускаем концентрации кристаллических веществ), записываем формулу константы химического равновесия:
 .
.
В эту формулу мы можем подставить только значение константы, т. к. данные концентрации являются начальными, а в константу входят равновесные концентрации, которые мы сейчас найдём. Пусть в ходе реакции образуется х молей вещества Q, следовательно, с учётом стехиометрических коэффициентов расходуется 2х моля вещества L. Значит, равновесные концентрации этих веществ:
[Q]Р = [Q]НАЧ + [Q]ОБР = 0, 2 + x
ставим знак «+», т. к. это продукт реакции и его концентрация с течением времени увеличивается;
[L]Р = [L]НАЧ – [L]ИЗР = 0, 5 – 2х
ставим знак «–», т. к. это исходное вещество и его концентрация с течением времени уменьшается.
Что касается концентрации вещества N, то его концентрацию определяем по тому же принципу: [Q] Р = [N] Р = 0, 2 + х (соотношение химических количеств 1: 1).
Подставляем эти данные в формулу и находим х:
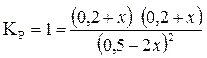 ;
;
0, 04 + 0, 4х + х2 = 0, 25 – 2х + 4х2;
0 = 3х2 – 2, 4х + 0, 21;
х = 0, 1.
Значит равновесные концентрации веществ в системе: [Q] Р = [N] Р = 0, 2 + 0, 1 = 0, 3 моль/л, а [L] Р = 0, 5 – 0, 2 = 0, 3 моль/л.