
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задачи для самостоятельного решения. 1 Окисление серы и ее диоксида протекает по уравнению:
|
|
1 Окисление серы и ее диоксида протекает по уравнению:
а) S(К) + О2(Г) = SO2(Г); б) 2SO2(Г) + О2(Г) = 2SO3(Г).
Как изменяются скорости этих реакций, если объемы каждой из систем увеличить в 4 раза?
2 Реакция идет по уравнению 2NO+Br2 = 2NOBr. Концентрации исходных веществ до начала реакции – [NO] = 0, 04 моль/л, [Br2] = 0, 01 моль/л. Вычислить концентрации этих веществ в момент, когда [NOBr] = 0, 005 моль/л.
3 Как изменится скорость реакции 2NO(Г)+O2(Г)= 2NO2(Г), если:
а) увеличить давление в системе в 4 раза;
б) понизить концентрацию NO в 5 раз?
Ответ пояснить.
4 Реакция идет по уравнению Н2+Br2 = 2HBr. Константа скорости этой реакции при некоторой температуре равна 0, 2. Исходные концентрации реагирующих веществ: [H2] = 0, 08 моль/л, [Br] = 0, 06 моль/л. Вычислить начальную скорость реакции и ее скорость, когда [H2] = 0, 05 моль/л.
5 Как нужно изменить температуру, чтобы скорость гомогенной реакции уменьшить в 27 раз при температурном коэффициенте, равном 3?
6 Как изменится скорость гомогенной реакции 2NO+O2 «2NO2 если концентрацию [NO] увеличить в 3 раза, а концентрацию [O2] уменьшить в 4 раза?
Химическое равновесие
Основные понятия. Константа химического равновесия
Все химические реакции можно разбить на две группы: необратимые и обратимые. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ. Обратимые реакции – это реакции, которые при одних и тех же условиях могут протекать как в прямом, так и в обратном направлении. (Впервые представление об обратимости химических реакций сформулировал К.Бертолле (1799)). Например, если смешать пары йода с водородом при температуре 200°С, то произойдет реакция H2 + I2 = 2HI.
Однако при этих же условиях йодоводород разлагается на йод и водород: 2HI = H2 + I2.
Понятно, что в этих условиях не произойдет ни полного разложения НI (так как продукты реакции способны вновь реагировать между собой), ни полного образования йодоводорода.
При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки: H2 + I2 ↔ 2HI
Реакцию, протекающую слева направо, называют прямой, справа налево — обратной.
Обратимые реакции не доходят до конца, в системе устанавливается химическое равновесие.
Термодинамическое условие равновесия – Δ G0х.р. = 0. Предположим, что энергия Гиббса (G) при переходе из системы А в систему В изменяется по закономерности, графически представленной на рисунке 7. Тогда
- до равновесного состояния будет протекать прямая реакция: А→ В, для которой Δ G прямой х.р. < 0;
- после равновесного состояния – обратная реакция: А← В (или В→ А), поскольку Δ G обратной х.р. < 0;
- в состоянии, когда энергия Гиббса не меняется (Δ G0х.р. = 0), протекает и прямая, и обратная реакции: А↔ В, т.е. наступает химическое равновесие.
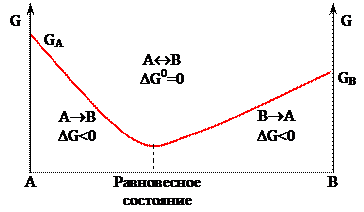
Рисунок 7 – Изменение энергии Гиббса (G) при переходе системы А в систему В.
Кинетическое условие равновесия - равенство скоростей прямой и обратной реакций: vпр. = vобр.. (рисунок 8)
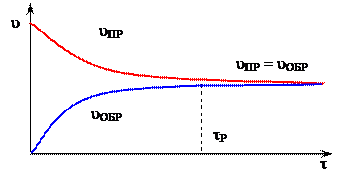
tР – время наступления равновесного состояния
Рисунок 8 – Изменение скорости прямой uПР и обратной uОБР реакции с течением времени t
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными: в системе устанавливается химическое равновесие.
После достижения состояния химического равновесия концентрации всех веществ в системе, как исходных, так и продуктов, постоянны (если не меняются условия, при которых находится система). Но это не означает, что реакции не протекают. Химическое равновесие является динамическим равновесием: протекает и прямая, и обратная реакции, но они протекают с одинаковой скоростью.
Количественно состояние химического равновесия характеризуется константой равновесия К. Выведем формулу для расчета константы равновесия для обратимой системы: H2(г) + I2(г) = 2HI(г), где и прямая, и обратная реакции являются простыми (элементарными). Согласно закону действия масс, скорости прямой (vпр) и обратной (vобр) реакций выражаются уравнениями:
vпр = kпр. [H2]. [I2], vобр = kобр. [HI ]2 .
Поскольку при равновесии скорости прямой и обратной реакций равны, то
kпр. [H2]. [I2] = kобр. [HI ]2 .
Собирая в правую сторону все концентрации компонентов реакции, а в левую – константы скоростей прямой и обратной реакций, и обозначая отношение констант скоростей kпр/kобр через К, получаем
К = kпр/kобр = [HI ]2/([H2]. [I2]).
Так как kпр и kобр при данной температуре являются величинами постоянными, то и К при данных условиях является величиной постоянной. Она называется константой равновесия данной реакции.
В общем случае для любой обратимой реакции aA + bB = cC +dD независимо от ее механизма протекания константа равновесия имеет вид:
К = kпр/kобр = [C]c. [D]d /([A]a. [B]b).
Таким образом, при постоянной температуре константа равновесия обратимой реакции представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции (числитель) и концентрациями исходных веществ (знаменатель), которое устанавливается при равновесии.
Константа равновесия определяет глубину протекания процесса к моменту достижения равновесного состояния и может меняться от нуля до бесконечности. Чем больше эта величина, тем больше степень превращения исходных веществ в продукты. Так, при К > > 1 равновесие смещено в сторону прямой реакции; при К < < 1 равновесие смещено в сторону обратной реакции.
В случае гетерогенных обратимых реакций в выражение константы равновесия не входят те вещества, концентрации которых являются постоянными при данных условиях. Например, для реакции СО2(г) + С(тв) = 2СО(г) константа равновесия имеет вид: К = [СО ]2/[СО2], так как концентрация твердых веществ С(тв) величина постоянная и не входит в выражение для константы равновеия.
Значение К зависит от природы реагирующих веществ и температуры и не зависит от присутствия катализатора. Наличие катализатора может ускорить или замедлить достижение равновесия, но не изменить соотношение концентраций всех веществ в момент равновесия.
Уравнение константы равновесия показывает, что в условии равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из этих веществ влечет за собой изменение концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.