
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Состояние равновесия
|
|
Реакции, протекающие при одних и тех же условиях одновременно в противоположных направлениях, называются обратимыми.
Рассмотрим простую обратимую реакцию, которая протекает в закрытой системе
A + B «C + D.
Скорость прямой реакции описывается уравнением


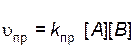 ,
,
где 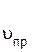 – скорость прямой реакции;
– скорость прямой реакции; 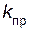 – константа скорости прямой реакции.
– константа скорости прямой реакции.
С течением времени концентрации реагентов А и В уменьшаются, скорость реакции снижается (рис.10, кривая 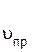 ).
).
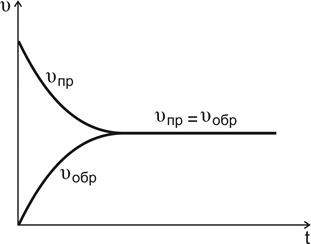
Рис.10. Изменение скоростей прямой и обратной реакций во времени
Реакция между А и В приводит к образованию веществ C и D, молекулы которых при столкновениях могут вновь дать вещества А и В.
Скорость обратной реакции описывается уравнением
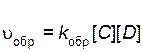 ,
,
где 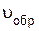 – скорость обратной реакции;
– скорость обратной реакции; 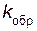 – константа скорости обратной реакции.
– константа скорости обратной реакции.
По мере того как концентрации веществ C и D возрастают, скорость обратной реакции увеличивается (рис.10, кривая 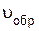 ).
).
В какой-то момент времени скорости прямой и обратной реакций становятся равными
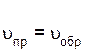 .
.
Такое состояние системы называется состоянием равновесия.
В состоянии равновесия концентрации всех его участников перестают меняться во времени. Такие концентрации называются равновесными.
Химическое равновесие – это динамическое равновесие. Неизменность концентраций веществ, присутствующих в закрытой системе, есть следствие непрерывно идущих химических процессов. Скорости прямой и обратной реакций не равны нулю, а нулю равна наблюдаемая скорость процесса.
Равенство скоростей прямой и обратной реакций – это кинетическое условие химического равновесия.