
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энтропия активации. Стерический фактор
|
|
Кроме энергии активации важным условием осуществления химической реакции является ориентация молекул в момент столкновения. Большую роль играют размеры и форма молекул, место расположения реакционно-способных атомов или групп атомов в молекуле.
Вероятность необходимой для взаимодействия ориентации молекул при столкновении
 ,
,
где, n взаим - число способов ориентации, приводящих к взаимодействию; n общ - общее число возможных способов ориентации. 
Энтропия активации (в расчете на 1 моль) по уравнению Больцмана
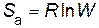 .
.
Вероятность необходимой ориентации
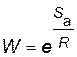 .
.
Чем больше вероятность необходимой для реакции ориентации, т.е. чем больше значение энтропии активации и чем меньше значение энергии активации, тем выше скорость реакции и, соответственно, константа скорости
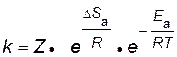 , ,
| (2.15) |
где Z – коэффициент пропорциональности.
Для бимолекулярных реакций Z – это число столкновений частиц в единице объема за единицу времени (1с, 1 см3).
Уравнение (2.15) называют основным уравнением химической кинетики. Энергия активации и энтропия активации являются теми факторами, посредством которых сказывается влияние природы реагирующих веществ на скорость реакции.
Множитель 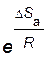 называется стерическим фактором (или стерическим множителем, или фактором вероятности).
называется стерическим фактором (или стерическим множителем, или фактором вероятности).
Стерический фактор 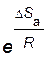 и частота столкновений Z учитываются в уравнении Аррениуса (2.14) через предэкспоненциальный множитель А.
и частота столкновений Z учитываются в уравнении Аррениуса (2.14) через предэкспоненциальный множитель А.