
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Скорость гетерогенной химической реакции
|
|
В гетерогенной химической реакции взаимодействие реагентов происходит на поверхности раздела фаз.
Скорость гетерогенной реакции измеряется изменением количества какого-либо из веществ, вступающих в реакцию или образующихся в результате ее, за единицу времени на единице поверхности раздела фаз
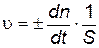 , ,
| (2.13) |
где n – количество вещества какого-либо компонента реакционной системы, моль; t – время, с; S – площадь поверхности раздела фаз, м2.
Из уравнения (2.13) следует, что скорость гетерогенной химической реакции имеет единицу измерения [моль∙ м -2 ∙ с -1]. Гетерогенные химические реакции являются сложными, многостадийными процессами. В ходе гетерогенной реакции можно выделить три характерные стадии.
1. Подвод реагирующих веществ к поверхности раздела фаз.
2. Химическая реакция на поверхности раздела фаз.
3. Отвод продуктов реакции из реакционной зоны.
Скорость суммарного гетерогенного процесса определяется наиболее медленной (лимитирующей) стадией.
Если наиболее медленно протекающими являются первая или третья стадии, связанные с переносом вещества, то скорость такого процесса определяется конвекцией (переносом массы газа или жидкости) или диффузией (самопроизвольным выравниванием концентраций) и практически не зависит от скорости протекания самой химической реакции.
При усилении конвекции скорость возрастает. Так, реакция горения угля протекает тем быстрее, чем интенсивнее подается к углю кислород
C (тв) + O2 (г) = CO2 (г).
При отсутствии конвекционного потока процесс может лимитироваться диффузией. Толщина диффузионного слоя уменьшается при перемешивании. Интенсивное перемешивание увеличивает скорость общего процесса. Например, растворение солей в водных растворах кислот
MgCO3 (тв) + 2 HNO3 (ж) = Mg(NO3)2 (р-р) + H2O (ж) + CO2 (г).
Если скорость переноса веществ больше, чем скорость химического превращения, т.е. наиболее медленной стадией является вторая стадия, то скорость протекания всего процесса определяется собственно химической реакцией и можно применить закон действующих масс.
При этом надо иметь в виду, что реакция протекает на поверхности раздела фаз, поэтому общая скорость химической реакции будет зависеть от концентрации жидкого или газообразного вещества, а также от площади соприкосновения фаз. Концентрация твердого вещества не входит в выражение для скорости реакции.
При измельчении твердого вещества скорость реакции будет возрастать из-за увеличения площади поверхности. Например, скорость реакции
CaCO3 (тв) + 2HCl (р-р) = CaCl2 (р-р) + H2O (ж) + CO2 (г)
зависит от концентрации соляной кислоты и площади поверхности раздела фаз. Скорость реакции порошкообразного карбоната кальция с кислотой выше скорости взаимодействия мраморной крошки с кислотой из-за увеличения площади контакта. Уравнение скорости в общем виде
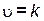 [HCl]m · S,
[HCl]m · S,
где m – порядок реакции по кислоте; S – площадь поверхности, м2.
Порядок реакции m может совпадать со значением стехиометрического коэффициента, если лимитирующей стадией процесса является собственно простая химическая реакция.