
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задачи для домашнего задания
|
|
1. Как изменится начальная скорость простой реакции, если:
| № задачи | Условие |
| 2А(г) + В(г) ® А2В(г)реакция для №1.1-1.8 | |
| 1.1 | концентрацию вещества А увеличить в 2 раза |
| 1.2 | концентрацию вещества В увеличить в 2 раза |
| 1.3 | увеличить давление в системе в 3 раза |
| 1.4 | уменьшить объем системы в 2 раза |
| 1.5 | уменьшить концентрацию веществ А и В в 3 раза |
| 1.6 | снизить давление в системе в 4 раза |
| 1.7 | увеличить объем системы в 2 раза |
| 1.8 | уменьшить концентрацию вещества А в 2 раза |
| А(г) + В(г) ® АВ(г)реакция для №1.9-1.16 | |
| 1.9 | концентрацию вещества А увеличить в 2 раза |
| 1.10 | концентрацию вещества В увеличить в 2 раза |
| 1.11 | увеличить давление в системе в 3 раза |
| 1.12 | уменьшить объем системы в 2 раза |
| 1.13 | уменьшить концентрацию веществ А и В в 3 раза |
| 1.14 | снизить давление в системе в 4 раза |
| 1.15 | увеличить объем системы в 2 раза |
| 1.16 | уменьшить концентрацию вещества А в 2 раза |
2. Скорость разложения вещества А описывается кинетическим уравнением первого порядка. Определить начальную концентрацию вещества [ А ]0, концентрацию вещества через t секунд после начала реакции [ A ]t, константу скорости реакции k, время реакции t.
| № задачи | [ A ]t, моль/л | [ А ]0, моль/л | k, с-1 | t, с | Конверсия, % | Определить |
| 2.1 | 0, 2 | 0, 003 | [ A ]t | |||
| 2.2 | 0, 026 | t | ||||
| 2.3 | 0, 2 | 0, 045 | [ А ]0 | |||
| 2.4 | 0, 045 | t | ||||
| 2.5 | 0, 1 | 0, 026 | [ A ]t | |||
| 2.6 | 0, 4 | 0, 8 | k | |||
| 2.7 | 0, 4 | 0, 013 | [ А ]0 | |||
| 2.8 | k | |||||
| 2.9 | k | |||||
| 2.10 | 0, 1 | 0, 3 | 0, 017 | t | ||
| 2.11 | 0, 5 | 0, 005 | [ A ]t | |||
| 2.12 | 0, 1 | 0, 025 | [ А ]0 | |||
| 2.13 | 0, 2 | 0, 4 | k | |||
| 2.14 | 0, 012 | t | ||||
| 2.15 | 0, 4 | 0, 012 | [ A ]t | |||
| 2.16 | 0, 3 | 0, 026 | [ А ]0 |
3. Как изменится скорость реакции A(г) + B(г) ® C(г) + D(г) при:
а) повышении (понижении) температуры, если энергия
активации реакции равна Е а (№ 3.1-3.10);
б) уменьшении Е а и температуре, равной Т оС
(№ 3.11 – 3.16).
| № задачи | Условие задачи | Е а, кДж/моль | T, °C |
| 3.1 | повышении температуры от 27 до 37°C | ||
| 3.2 | понижении температуры от 45 до 30°C | ||
| 3.3 | повышении температуры от 20 до 40°C | ||
| 3.4 | понижении температуры от 60 до 25°C | ||
| 3.5 | повышении температуры от 10 до 27°C | ||
| 3.6 | повышении температуры от 27 до 37°C | ||
| 3.7 | понижении температуры от 45 до 30°C | ||
| 3.8 | повышении температуры от 20 до 40°C | ||
| 3.9 | понижении температуры от 60 до 25°C | ||
| 3.10 | повышении температуры от 10 до 27°C | ||
| 3.11 | уменьшении энергии активации на 4 кДж | ||
| 3.12 | уменьшении энергии активации на 10 кДж | ||
| 3.13 | уменьшении энергии активации на 20 кДж | ||
| 3.14 | уменьшении энергии активации на 25 кДж | ||
| 3.15 | уменьшении энергии активации на 7 кДж | ||
| 3.16 | уменьшении энергии активации на 12 кДж |
4. Для реакции с заданной константой равновесия Kс и начальными концентрациями газообразных исходных веществ C 0рассчитайте равновесные концентрации исходных веществ и продуктов:
| № задачи | Реакция | Kс |
C 0,
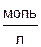
|
| 4.1 | CO(г) + H2O(г) «CO2(г) + H2(г) | 2, 2 | 0, 02 |
| 4.2 | FeO(тв) + CO(г)«Fe(тв) + CO2(г) | 13, 6 | 0, 04 |
| 4.3 | 2HI(г)«H2(г) + I2(г) | 0, 5 | 0, 02 |
| 4.4 | SO2 (г) + CO 2 (г) «SO3 (г) + CO (г) | 0, 5 | 0, 01 |
| 4.5 | H 2(г) + SO3 (г) «H 2O (г) + SO2 (г) | 1, 3 | 0, 01 |
| 4.6 | 2CuO (тв) + CO (г)«Cu 2O (тв) + CO 2 (г) | 15, 8 | 0, 03 |
| 4.7 | 2HBr (г) «H 2(г) + Br 2(г) | 0, 4 | 0, 04 |
| 4.8 | H 2 (г) + Cl2 (г) «2HCl (г) | 3, 7 | 0, 01 |
| 4.9 | N 2 (г) + O 2 (г) «2NO (г) | 3, 4 | 0, 02 |
| 4.10 | SO3 (г) + CO (г) «SO2(г) + CO 2(г) | 1, 9 | 0, 02 |
| 4.11 | H 2(г) + Br 2(г) «2HBr (г) | 2, 8 | 0, 01 |
| 4.12 | 2HCl (г) «H 2 (г) + Cl2 (г) | 0, 3 | 0, 03 |
| 4.13 | Fe 2O 3(тв) + CO(г) «2FeO(тв) + CO2 (г) | 11, 3 | 0, 04 |
| 4.14 | H 2 (г) + CO 2 (г) «H 2O (г) + CO (г) | 2, 6 | 0, 01 |
| 4.15 | 2NO (г) «O 2 (г) + N 2 (г) | 0, 3 | 0, 04 |
| 4.16 | NiO (тв) + H 2 (г) «Ni (тв) + H 2O (г) | 5, 6 | 0, 03 |
5. Определите константу равновесия Kс и начальные концентрации исходных веществ для гомогенной газообразной реакции, если равновесие в системе установилось при следующих концентрациях: [ A ]равн = 0, 04 моль/л; [ B ]равн = 0, 05 моль/л; [ C ]равн = 0, 08 моль/л.
| № задачи | Реакция |
| 5.1 | A + B «C + D |
| 5.2 | 2A + B «C + D |
| 5.3 | A + B «2C + D |
| 5.4 | A + B «2С |
| 5.5 | A + 2B «C + D |
| 5.6 | 2A «C + D |
| 5.7 | 2A «2C + D |
| 5.8 | 2B «C + 2D |
| 5.9 | A + B «2C |
| 5.10 | A + B «C + 2D |
| 5.11 | 2B «C + D |
| 5.12 | A + B «C |
| 5.13 | 2A «C + 2D |
| 5.14 | A + B «С |
| 5.15 | A «C + D |
| 5.16 | 2B «2C + D |
6. На основании принципа Ле Шателье, определите в каком направлении сместится равновесие в системе при повышении: а) давления (T = const); б) температуры.
| № задачи | Реакция |
| 6.1 | COCl2(г) «CO(г) + Cl2(г); D H° > 0 |
| 6.2 | H2(г) + I2(г) «2HI(г); D H° > 0 |
| 6.3 | 2CO (г)+ O 2 (г) «2CO2 (г); D H° < 0 |
| 6.4 | N 2 (г) +O 2 (г) «2NO (г); D H° > 0 |
| 6.5 | 2H 2 (г) + O 2 (г) «2H 2O (г); D H° < 0 |
| 6.6 | 4HCl (г) + O 2 (г) «2H 2O (г) + 2 Cl2 (г); D H° < 0 |
| 6.7 | 2NO (г) +O 2 (г) «2NO 2 (г); D H° < 0 |
| 6.8 | 2SO3 (г) «2SO2 (г) + O 2 (г); D H° > 0 |
| 6.9 | 2O3 (г) «3O2 (г); D H° < 0 |
| 6.10 | CO (г)+ 2H 2 (г) «CH3OH (г); D H° < 0 |
| 6.11 | N 2O 4 (г) «2NO 2 (г); D H° > 0 |
| 6.12 | 2H 2O (г) «2H 2 (г) + O 2 (г); D H° > 0 |
| 6.13 | SO3 (г) + NO (г) «SO2 (г) + NO 2 (г); D H° > 0 |
| 6.14 | N 2 (г) +3H 2 (г) «2NH3 (г); D H° < 0 |
| 6.15 | CH4 (г) + 2H 2O(г) «CO2(г) +4H2(г); D H°> 0 |
| 6.16 | PCl5(г) «PCl3(г) + Cl2(г); D H° > 0 |
7. Определить вид дифференциального кинетического уравнения и константу скорости реакции
n А + m В ® продукты,
если в трех опытах при начальных концентрациях вещества В = 0, 2; 0, 4; 0, 6 моль/ли фиксированной концентрации вещества А, равной [ A ]0 моль/л, скорости реакции имели значения  1,
1,  2,
2,  3. В трех последующих опытах при различных начальных концентрациях [ А ] = 0, 1; 0, 3; 0, 5 моль/ли постоянной концентрации В, равной [ B ]0 моль/л, скорости реакции имели значения
3. В трех последующих опытах при различных начальных концентрациях [ А ] = 0, 1; 0, 3; 0, 5 моль/ли постоянной концентрации В, равной [ B ]0 моль/л, скорости реакции имели значения  4,
4,  5,
5,  6.
6.
Значения  1 -
1 -  6, [ A ]0 и [ B ]0 приведены в табл. 4.
6, [ A ]0 и [ B ]0 приведены в табл. 4.
8. Приведенные ниже данные соответствуют температурной зависимости константы скорости реакции А ® продукты, имеющей первый порядок
| Температура, К | Т 1 | Т 2 | Т 3 |
| Константа k, с-1 | 0, 0012 | 0, 0027 | 0, 0061 |
Определите энергию активации и значение предэкспоненциального множителя. Рассчитайте константу скорости при температуре T 4 и определите концентрацию вещества А через 100 с после начала реакции, если известно, что начальная концентрация вещества А равна 2 моль/л. Значения Т 1, Т 2, Т 3, T 4 приведены в табл. 5.
9. Химическое равновесие гомогенной реакции, протекающей при T = const, установилось при следующих концентрациях реагирующих веществ (моль/л): [ А ], [ B ], [ C ], [ D ]. Затем концентрацию вещества А увеличили до m моль/л.
Рассчитайте новые равновесные концентрации реагирующих веществ. Реакция и значения [ А ], [ B ], [ C ], [ D ], m приведены в табл. 6.
Таблица 4
| № задачи | Концентрация, моль/л | Скорость реакции, моль/л·с | ||||||
| [ A ]0 | [ B ]0 |  1 1
|  2 2
|  3 3
|  4 4
|  5 5
|  6 6
| |
| 7.1 | 1, 1 | 1, 3 | 0, 1320 | 0, 2640 | 0, 3960 | 0, 0780 | 0, 2340 | 0, 3920 |
| 7.2 | 1, 4 | 2, 25 | 0, 3140 | 0, 6270 | 0, 9400 | 0, 0180 | 0, 1620 | 0, 4510 |
| 7.3 | 1, 4 | 1, 6 | 0, 1680 | 0, 3360 | 0, 5040 | 0, 0960 | 0, 2880 | 0, 4800 |
| 7.4 | 1, 2 | 1, 4 | 0, 2300 | 0, 4600 | 0, 6900 | 0, 0112 | 0, 1010 | 0, 2850 |
| 7.5 | 1, 3 | 1, 5 | 0, 1560 | 0, 3130 | 0, 4680 | 0, 0900 | 0, 2700 | 0, 4500 |
| 7.6 | 1, 1 | 1, 3 | 0, 1940 | 0, 3880 | 0, 5820 | 0, 0104 | 0, 0940 | 0, 2600 |
| 7.7 | 1, 1 | 1, 4 | 0, 1320 | 0, 2640 | 0, 3690 | 0, 0840 | 0, 2530 | 0, 4210 |
| 7.8 | 1, 3 | 1, 2 | 0, 0208 | 0, 0832 | 0, 1870 | 0, 0576 | 0, 1730 | 0, 2880 |
| 7.9 | 1, 2 | 1, 5 | 0, 1440 | 0, 2880 | 0, 4320 | 0, 0900 | 0, 2700 | 0, 4500 |
| 7.10 | 1, 4 | 1, 1 | 0, 0224 | 0, 0900 | 0, 2020 | 0, 0484 | 0, 1450 | 0, 2420 |
| 7.11 | 1, 1 | 1, 6 | 0, 1320 | 0, 2640 | 0, 3960 | 0, 0960 | 0, 2880 | 0, 4800 |
| 7.12 | 1, 3 | 1, 3 | 0, 0208 | 0, 0832 | 0, 1870 | 0, 0675 | 0, 2030 | 0, 3380 |
| 7.13 | 1, 2 | 1, 3 | 0, 1440 | 0, 2880 | 0, 4320 | 0, 0780 | 0, 2340 | 0, 3920 |
| 7.14 | 1, 4 | 1, 2 | 0, 0224 | 0, 9000 | 0, 2020 | 0, 0576 | 0, 1730 | 0, 2880 |
| 7.15 | 1, 3 | 1, 4 | 0, 1560 | 0, 3130 | 0, 4680 | 0, 0840 | 0, 2530 | 0, 4210 |
| 7.16 | 1, 3 | 1, 1 | 0, 0208 | 0, 0832 | 0, 1870 | 0, 0484 | 0, 1450 | 0, 2420 |
Таблица 5
| № задачи | Температура, К | |||
| Т 1 | Т 2 | Т 3 | T 4 | |
| 8.1 | ||||
| 8.2 | ||||
| 8.3 | ||||
| 8.4 | ||||
| 8.5 | ||||
| 8.6 | ||||
| 8.7 | ||||
| 8.8 | ||||
| 8.9 | ||||
| 8.10 | ||||
| 8.11 | ||||
| 8.12 | ||||
| 8.13 | ||||
| 8.14 | ||||
| 8.15 | ||||
| 8.16 |
Таблица 6
| № задачи | Реакция | Концентрация, моль/л | ||||
| [ А ] | [ В ] | [ C ] | [ D ] | m | ||
| 9.1 | A + B «C + D | 0, 2 | 0, 3 | 0, 2 | 0, 3 | 0, 4 |
| 9.2 | A + B «2C | 0, 1 | 0, 2 | 0, 3 | 0, 2 | |
| 9.3 | A + B «C + D | 0, 3 | 0, 2 | 0, 3 | 0, 3 | 0, 4 |
| 9.4 | 2A «B + C | 0, 1 | 0, 2 | 0, 2 | 0, 2 | |
| 9.5 | A + B «C + D | 0, 2 | 0, 4 | 0, 2 | 0, 2 | 0, 3 |
| 9.6 | A + B «2C | 0, 2 | 0, 3 | 0, 2 | 0, 3 | |
| 9.7 | A + B «C + D | 0, 2 | 0, 3 | 0, 2 | 0, 3 | 0, 3 |
| 9.8 | A + B «C + D | 0, 1 | 0, 4 | 0, 2 | 0, 2 | 0, 3 |
| 9.9 | 2A «B + C | 0, 3 | 0, 3 | 0, 3 | 0, 4 | |
| 9.10 | A + B «C + D | 0, 3 | 0, 3 | 0, 2 | 0, 3 | 0, 4 |
| 9.11 | A + B «2C | 0, 1 | 0, 1 | 0, 2 | 0, 2 | |
| 9.12 | A + B «C + D | 0, 2 | 0, 2 | 0, 2 | 0, 3 | 0, 3 |
| 9.13 | 2A «B + C | 0, 1 | 0, 1 | 0, 1 | 0, 2 | |
| 9.14 | A + B «2C | 0, 1 | 0, 2 | 0, 1 | 0, 2 | |
| 9.15 | A + B «C + D | 0, 1 | 0, 1 | 0, 1 | 0, 1 | 0, 2 |
| 9.16 | 2A «B + C | 0, 1 | 0, 1 | 0, 2 | 0, 2 |
Варианты домашних заданий
| № варианта | № задачи |
| 1.1, 2.1, 3.1, 4.1, 5.1, 6.1 | |
| 1.2, 2.2, 3.2, 4.2, 5.2, 6.2 | |
| 1.3, 2.3, 3.3, 4.3, 5.3, 6.3 | |
| 1.4, 2.4, 3.4, 4.4, 5.4, 6.4 | |
| 1.5, 2.5, 3.5, 4.5, 5.5, 6.5 | |
| 1.6, 2.6, 3.6, 4.6, 5.6, 6.6 | |
| 1.7, 2.7, 3.7, 4.7, 5.7, 6.7 | |
| 1.8, 2.8, 3.8, 4.8, 5.8, 6.8 | |
| 1.9, 2.9, 3.9, 4.9, 5.9, 6.9 | |
| 1.10, 2.10, 3.10, 4.10, 5.10, 6.10 | |
| 1.11, 2.11, 3.11, 4.11, 5.11, 6.11 | |
| 1.12, 2.12, 3.12, 4.12, 5.12, 6.12 | |
| 1.13, 2.13, 3.13, 4.13, 5.13, 6.13 | |
| 1.14, 2.14, 3.14, 4.14, 5.14, 6.14 | |
| 1.15, 2.15, 3.15, 4.15, 5.15, 6.15 | |
| 1.16, 2.16, 3.16, 4.16, 5.16, 6.16 |
Варианты дополнительных домашних заданий
| № варианта | № задачи |
| 7.1, 8.1, 9.1 | |
| 7.2, 8.2, 9.2 | |
| 7.3, 8.3, 9.3 | |
| 7.4, 8.4, 9.4 | |
| 7.5, 8.5, 9.5 | |
| 7.6, 8.6, 9.6 | |
| 7.7, 8.7, 9.7 | |
| 7.8, 8.8, 9.8 | |
| 7.9, 8.9, 9.9 | |
| 7.10, 8.10, 9.10 | |
| 7.11, 8.11, 9.11 | |
| 7.12, 8.12, 9.12 | |
| 7.13, 8.13, 9.13 | |
| 7.14, 8.14, 9.14 | |
| 7.15, 8.15, 9.15 | |
| 7.16, 8.16, 9.16 |